题目内容
3.研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl.下列关于“水”电池的说法不正确的是( )| A. | AgCl是还原产物 | |
| B. | 负极的电极反应为:Ag+Cl--e-═AgCl | |
| C. | Na+不断向“水”电池的正极移动 | |
| D. | 每生成1mol Na2Mn5O10转移2mol电子 |
分析 根据电池总反应可判断出反应中Ag的化合价升高,被氧化,Ag应为原电池的负极,AgCl是氧化产物;方程式中5MnO2生成1Na2Mn5O10,化合价共降低了2价,所以每生成1molNa2Mn5O10转移2mol电子;在原电池中阴离子向负极移动,阳离子向正极移动,以形成闭合电路.
解答 解:A、反应中Ag的化合价升高,被氧化,Ag应为原电池的负极,AgCl是氧化产物,故A错误;
B、根据电池总反应:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,可判断出Ag应为原电池的负极,负极发生反应的电极方程式为:Ag+Cl--e-=AgCl,故B正确;
C、在原电池中阴离子向负极移动,阳离子向正极移动,故C正确;
D、根据方程式中5MnO2生成1Na2Mn5O10,化合价共降低了2价,所以每生成1molNa2Mn5O10转移2mol电子,故D正确;
故选:A.
点评 本题考查原电池的电极反应和离子的定向移动以及电化学的简单计算,做题时要注意总电池反应式的判断利用,运用两极上的反应特点做题,分析Mn元素的化合价变化是该题的难点.

练习册系列答案
相关题目
13.化学与人类生活、生产和社会可持续发展密切相关.下列说法正确的是( )
| A. | 在食品袋中放入硅胶、生石灰的透气小袋,可防止食物受潮、氧化变质 | |
| B. | 天然气、酒精和汽油分别属于化石能源、不可再生能源和二次能源 | |
| C. | 富含N、P元素的生活用水可以直接用来灌溉农田 | |
| D. | 酸雨样品露天放置一段时间,酸性增强,是由于雨水所含成分被氧化的原因 |
8.下列实验装置能达到相应实验目的是( )
| A. |  用装置制备Fe(OH)2并能较长时间观察其颜色 | |
| B. |  用装置制备并收集少量氨气 | |
| C. |  用装置除去H2S中的水蒸气 | |
| D. |  用装置制取纯净的乙酸乙酯 |
13.判断给定化学反应是否为氧化还原反应的依据是( )
| A. | 看反应前后是否有氧原子的得失 | |
| B. | 看反应前后是否有原子的重新组合 | |
| C. | 看反应前后是否有元素的化合价发生改变 | |
| D. | 看反应后是否有气体生成 |
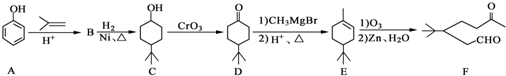
 .
. .同时满足下列条件的B的同分异构体(不包括B)共有11种:能与FeCl3溶液显紫色,苯环上只有两个取代基.
.同时满足下列条件的B的同分异构体(不包括B)共有11种:能与FeCl3溶液显紫色,苯环上只有两个取代基. (任写一种).
(任写一种).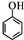 )和CH2=CH2为原料制备有机物
)和CH2=CH2为原料制备有机物  的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: 下列框图中的物质均为中学化学中常见物质,其中甲、乙为单质,其余均为化合物.B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色.
下列框图中的物质均为中学化学中常见物质,其中甲、乙为单质,其余均为化合物.B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色.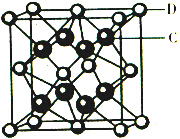 已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大.A原子基态时最外层电子数是其内层电子总数的2倍,B原子基态时s电子数与P电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的.F原子核外最外层电子数与Na相同,其余各层电子均充满.
已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大.A原子基态时最外层电子数是其内层电子总数的2倍,B原子基态时s电子数与P电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的.F原子核外最外层电子数与Na相同,其余各层电子均充满.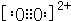 ,1mol B22+中含有的π键数目为2NA.
,1mol B22+中含有的π键数目为2NA. 该离子化合物晶体的密度为a g/cm3,则晶胞的体积是$\frac{312}{a{N}_{A}}$ cm3(只要求列算式,阿伏加德罗常数的值为NA).
该离子化合物晶体的密度为a g/cm3,则晶胞的体积是$\frac{312}{a{N}_{A}}$ cm3(只要求列算式,阿伏加德罗常数的值为NA).