题目内容
18.在100mL下列溶液中,分别加入0.05molNaOH固体,溶液的导电能力变化不大的是( )| A. | 蒸馏水 | B. | 0.5 mol/L的醋酸溶液 | ||
| C. | 0.5 mol/L的盐酸 | D. | 0.5 mol/L的氨水 |
分析 溶液混合后导电能力变化的大小,关键是看混合后溶液中自由移动的离子浓度的变化.
A.水是极弱的电解质,加入NaOH后为强电解质的溶液,导电性变化大;
B.0.5mol•L-1醋酸原来是弱电解质,离子较少,加入强碱以后,变为强电解质;
C.盐酸是强酸,向溶液中加入氢氧化钠后,氢氧化钠和硝酸反应生成氯化钠和水;
D.氨水是弱电解质,氢氧化钠是强电解质,据此回答判断.
解答 解:导电能力的大小与单位体积内离子浓度的多少成正比,溶液混合后导电能力变化的大小,关键是看混合后溶液中自由移动的离子浓度的变化.
A.因水是极弱的电解质,导电性极弱,加入氢氧化钠后,氢氧化钠是强电解质,溶液中主要的是钠离子和氢氧根离子,导电性增强,故A错误;
B.0.5mol•L-1醋酸原来是弱电解质,离子较少,加入强碱以后,变为强电解质,导电能力增强,所以导电性变化大,故C错误;
C、盐酸是强酸,向溶液中加入氢氧化钠后,氢氧化钠和硝酸反应生成氯化钠和水,硝酸钠是强电解质,所以离子浓度变化不大,所以溶液导电能力变化不大,故C正确;
D、氨水是弱电解质,加入0.05molNaOH固体,氢氧化钠是强电解质,离子的浓度变大,故导电性变大,故D错误;
故选C.
点评 本题考查溶液中离子浓度大小与溶液的导电性关系,溶液混合后导电能力变化的大小,关键是看混合后溶液中自由移动的离子浓度的变化,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.下列实验装置能达到相应实验目的是( )
| A. |  用装置制备Fe(OH)2并能较长时间观察其颜色 | |
| B. |  用装置制备并收集少量氨气 | |
| C. |  用装置除去H2S中的水蒸气 | |
| D. |  用装置制取纯净的乙酸乙酯 |
13.判断给定化学反应是否为氧化还原反应的依据是( )
| A. | 看反应前后是否有氧原子的得失 | |
| B. | 看反应前后是否有原子的重新组合 | |
| C. | 看反应前后是否有元素的化合价发生改变 | |
| D. | 看反应后是否有气体生成 |
3.化学与社会、技术、环境、生活密切相关.下列说法正确的是( )
| A. | 碘是人体必需的微量元素,所以要多吃富含高碘酸的食物 | |
| B. | 空气中直径小于或等于2.5?m的颗粒物称为PM2.5 | |
| C. | pH<7的雨水称为酸雨,对环境造成很大的危害 | |
| D. | 甲醛的水溶液可以作为鱿鱼等海鲜的防腐剂 |
10.下列物质既能通过化合反应,又能通过复分解反应生成的是( )
①Fe(OH)3 ②Fe(NO3)2 ③NaHCO3 ④Al2S3 ⑤NH4Cl ⑥NaOH.
①Fe(OH)3 ②Fe(NO3)2 ③NaHCO3 ④Al2S3 ⑤NH4Cl ⑥NaOH.
| A. | ④除外都可以 | B. | 除②④外都可以 | C. | 只有①⑤⑥可以 | D. | 全部都可以 |
7.下列反应中,HCl作为氧化剂的是( )
| A. | HCl+AgNO3═HNO3+AgCl↓ | B. | Mg+2HCl═MgCl2+H2↑ | ||
| C. | MnO2+4HCl═MnCl2+Cl2↑+2H2O | D. | Au+HNO3+4HCl═HAuCl4+NO↑+2H2O |
 ;元素Z的离子结构示意图为
;元素Z的离子结构示意图为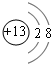 .
.

 .
.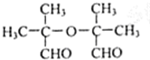 .
.