题目内容
1.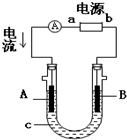 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:(1)若A、B都是惰性电极,c是饱和NaCl溶液,实验开始时,同时在U形管两边各滴入几滴酚酞试液,则:
①B是阴 极(填“阴”或“阳”) B极逸出无色(填:黄绿或无色)气体,同时B极附近溶液呈红色.
②电解池中A极上的电极反应式为2Cl--2e-=Cl2↑.B极上的电极反应式为2H++2e-=H2↑.
(2)如要进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,电解液c选用CuSO4溶液,则:
①A电极的材料是粗铜,电极反应式是Cu-2e-=Cu2+.
②B电极的材料是精铜,电极反应式是Cu2++2e-=Cu.
(说明:杂质发生的电极反应不必写出)
③下列说法正确的是bd.
a.电能全部转化为化学能 b.在电解精炼过程中,电解液中伴随有Al3+、Zn2+产生
c.溶液中Cu2+向阳极移动 d.利用阳极泥可回收Ag、Pt、Au等金属
(3)用惰性电极电解CuSO4溶液.若阴极析出Cu的质量为12.8g,则阳极上产生的气体在标准状况下的体积为2.24L.
(4)利用反应2Cu+O2+2H2SO4═2CuSO4+2H2O可制备CuSO4,若将该反应设计为电解池,其电解质溶液需用硫酸溶液,阳极材料是用铜,阴极电极反应式为O2+4H++4e-=2H2O.
分析 (1)电解池中,电流是从正极流出,所以A是阳极,B是阴极,电解氯化钠溶液,在阳极上是氯离子失电子的氧化反应,在阴极上是氢离子得电子的还原反应,据此回答;
(2)①电解精炼中,粗铜作阳极,A是阳极,则A极材料是粗铜,阳极上铜失电子发生氧化反应;
②电解精炼中,纯铜作阴极,B是阴极,B材料是粗铜,该极上铜离子得电子生成金属铜;
③a.电解池中电能转化为化学能和热能;
b.在电解精炼过程中,阳极上金属铝、锌等先于铜失电子;
c.溶液中阳离子向阴极移动;
d.阳极上金属铝、锌、铜等失电子,Ag、Pt、Au等金属形成阳极泥.
(3)根据两极电极反应式结合电子守恒进行计算即可;
(4)该反应不能自发进行,所以只能设计成电解池,失电子的金属作阳极,反应方程式中溶液为电解质溶液,阴极上得电子发生还原反应.
解答 解:(1)①根据电流方向知,a是正极,A是阳极,b是负极,B是阴极,电解氯化钠溶液,在阳极上是氯离子失电子的氧化反应,产生氯气,在阴极上是氢离子得电子的还原反应,产生氢气,该电极附近产生高浓度的氢氧化钠,遇到酚酞显示红色,故答案为:阴;无色;红;
②在阳极上是氯离子失电子的氧化反应,产生氯气,电极反应为:2Cl--2e-=Cl2↑,在阴极上是氢离子得电子的还原反应,产生氢气,电极反应为:2H++2e-=H2↑,故答案为:2Cl--2e-=Cl2↑;2H++2e-=H2↑;
(2)①电解精炼中,粗铜作阳极,纯铜作阴极,A是阳极,则A极材料是粗铜,阳极上铜失电子发生氧化反应,电极反应式为:Cu-2e-=Cu2+,故答案为:粗铜;Cu-2e-=Cu2+;
②B是阴极,B材料是粗铜,该极上铜离子得电子生成金属铜,即电极反应式为:Cu2++2e-=Cu,
故答案为:精铜;Cu2++2e-=Cu;
③a.电能转化为化学能和热能,故错误;
b.在电解精炼过程中,阳极上金属铝、锌等失电子,电解液中伴随有Al3+、Zn2+产生,故正确;
c.溶液中Cu2+向阴极移动,故错误;
d.阳极上金属铝、锌、铜等失电子,Ag、Pt、Au等金属形成阳极泥,利用阳极泥可回收Ag、Pt、Au等金属,故正确.故选bd.
(3)电解硫酸铜,在阴极发生反应:Cu2++2e-═Cu,析出Cu的质量为12.8g即0.2mol,所以转移电子0.4mol,在阳极上发生反应:4OH--4e-=O2+2H2O,根据转移电子相等,得阳极上产生的气体在标准状况下的体积=0.1mol×22.4L/mol=2.24L,
故答案为:2.24;
(4)该反应不能自发进行,所以只能设计成电解池,失电子的金属作阳极,反应方程式中溶液为电解质溶液,阴极上得电子发生还原反应,所以若将该反应设计为电解池,其电解质溶液需用稀硫酸,阳极材料是用 铜,阴极电极反应式为O2+4H++4e-=2H2O,
故答案为:硫酸溶液;铜;O2+4H++4e-=2H2O.
点评 本题考查了电解原理,正确判断阴阳极是解本题关键,注意根据转移电子守恒计算阳极上生成气体的体积,为难点.

| A. | 看反应前后是否有氧原子的得失 | |
| B. | 看反应前后是否有原子的重新组合 | |
| C. | 看反应前后是否有元素的化合价发生改变 | |
| D. | 看反应后是否有气体生成 |
①Fe(OH)3 ②Fe(NO3)2 ③NaHCO3 ④Al2S3 ⑤NH4Cl ⑥NaOH.
| A. | ④除外都可以 | B. | 除②④外都可以 | C. | 只有①⑤⑥可以 | D. | 全部都可以 |
| A. | 标况下,1molC6H1206含氧原子数为6NA | |
| B. | 0.1moICl2与足量水充分混合,转移电子数为0.1NA | |
| C. | 25℃,pH=13的Ba(OH)2溶液含有OH-数目为0.2NA | |
| D. | 22.4L N2和NH3混合气体含共用电子对数目为3NA |
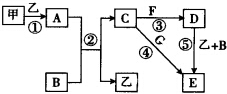 下列框图中的物质均为中学化学中常见物质,其中甲、乙为单质,其余均为化合物.B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色.
下列框图中的物质均为中学化学中常见物质,其中甲、乙为单质,其余均为化合物.B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色. ;元素Z的离子结构示意图为
;元素Z的离子结构示意图为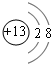 .
.

 .
.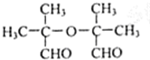 .
.