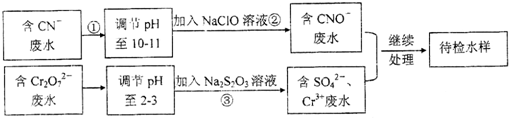
题目内容
8.a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg五种金属中的一种.已知(1)a、d、e均能与稀盐酸反应产生氢气;(2)b能从c的盐溶液中置换出c单质;(3)a与强碱溶液反应放出气体;(4)a、e在冷浓硝酸或浓硫酸中发生钝化.由此可判断a、b、c、d、e依次是( )| A. | Fe、Cu、Ag、Al、Mg | B. | Mg、Cu、Al、Ag、Fe | C. | Al、Cu、Ag、Mg、Fe | D. | Mg、Ag、Cu、Al、Fe |
分析 Fe、Al、Mg为活泼金属,可与稀盐酸反应生成氢气,Al可与氢氧化钠溶液反应,较活泼金属能将较不活泼金属从盐中置换出来,Fe、Al在冷浓硝酸或浓硫酸中发生钝化,以此解答该题.
解答 解:a与强碱反应放出气体,说明a是Al;
a、e在冷浓硝酸或浓硫酸中发生钝化,已知Fe、Al在冷浓硝酸或浓硫酸中发生钝化,说明e为Fe;
a、d、e均能与稀盐酸反应产生氢气,说明d为Mg;
b能从c的盐溶液中置换出c单质,说明b的活泼性大于c,则b为Cu,c为Ag;
故a、b、c、d、e依次是Al、Cu、Ag、Mg、Fe;
故选C.
点评 本题考查元素化合物知识,侧重于学生的分析能力的考查,注意排在氢前面的金属能和酸反应产生氢气,活泼的金属能将不活泼的金属从其盐溶液中置换出来,铝和强碱反应放氢气,铁和铝在冷浓硫酸中发生钝化,难道不大.

练习册系列答案
相关题目
19.某小组同学用如图所示装置研究电化学原理.下列关于该原电池的说法不正确的是( )

| A. | 原电池的总反应为Fe+Cu2+═Fe2++Cu | |
| B. | 盐桥中是KNO3溶液,则盐桥中NO3-移向乙烧杯 | |
| C. | 其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为2H++2e-═H2↑ | |
| D. | 反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过0.2mol电子 |
3.在理论上不能用于设计原电池的化学反应是( )
| A. | H2SO4(aq)+BaCl2(aq)═BaSO4(s)+2HCl(aq)△H<0 | |
| B. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H<0 | |
| C. | 4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)△H<0 | |
| D. | 3Cu(s)+8HNO3(aq)═3Cu(NO3)2(aq)+2NO(g)+4H2O(l)△H<0 |
13.判断给定化学反应是否为氧化还原反应的依据是( )
| A. | 看反应前后是否有氧原子的得失 | |
| B. | 看反应前后是否有原子的重新组合 | |
| C. | 看反应前后是否有元素的化合价发生改变 | |
| D. | 看反应后是否有气体生成 |
20.二氧化锰是制造锌锰干电池的基本材料.工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如图:
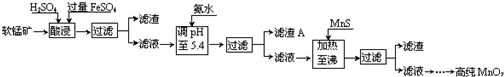
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
(1)FeSO4在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O.
(2)pH要调到5.4,应该使用pH计或精密pH试纸(填写仪器或试剂名称).滤渣A的主要成分是Fe(OH)3和Al(OH)3.
(3)加入MnS的目的是除去Cu2+、Zn2+杂质.
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为MnO2+H2O+e-=MnOOH+OH-.
(5)从废旧碱性锌锰电池中可以回收利用的物质有锌、二氧化锰(写两种).
(6)已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+?Fe3++3H2O的平衡常数K=2.79×103.

某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
(2)pH要调到5.4,应该使用pH计或精密pH试纸(填写仪器或试剂名称).滤渣A的主要成分是Fe(OH)3和Al(OH)3.
(3)加入MnS的目的是除去Cu2+、Zn2+杂质.
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为MnO2+H2O+e-=MnOOH+OH-.
(5)从废旧碱性锌锰电池中可以回收利用的物质有锌、二氧化锰(写两种).
(6)已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+?Fe3++3H2O的平衡常数K=2.79×103.
18.A、B、C、D、M均为中学化学常见物质,它们的转化关系如图所示(部分生成物和反应条件略去),其中A与H2O的反应在常温下进行,下列推断不正确的是( )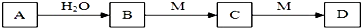
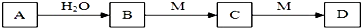
| A. | 若M为具有臭鸡蛋气味的气体,则D可能为酸式盐,且M(A)=M(C) | |
| B. | 若M为铁,则向D的溶液中通入A可能得C | |
| C. | 若C为纯碱,C转化为D的反应是CO32-+H2O+CO2═2HCO3-,则A可能为氯气 | |
| D. | 若M为可溶性铝盐,则A与水反应可能产生氢气,也可能产生氧气 |
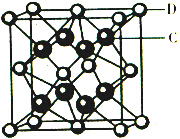 已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大.A原子基态时最外层电子数是其内层电子总数的2倍,B原子基态时s电子数与P电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的.F原子核外最外层电子数与Na相同,其余各层电子均充满.
已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大.A原子基态时最外层电子数是其内层电子总数的2倍,B原子基态时s电子数与P电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的.F原子核外最外层电子数与Na相同,其余各层电子均充满.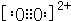 ,1mol B22+中含有的π键数目为2NA.
,1mol B22+中含有的π键数目为2NA. 该离子化合物晶体的密度为a g/cm3,则晶胞的体积是$\frac{312}{a{N}_{A}}$ cm3(只要求列算式,阿伏加德罗常数的值为NA).
该离子化合物晶体的密度为a g/cm3,则晶胞的体积是$\frac{312}{a{N}_{A}}$ cm3(只要求列算式,阿伏加德罗常数的值为NA).