题目内容
下列叙述中的前后两个量之比为1:2的是( )
| A、相同温度下,pH=12的Ba(OH)2与pH=12的KOH溶液中,c〔(Ba(OH)2〕:c(KOH) |
| B、相同温度下,0.1mol/L乙酸溶液与0.2mol/L乙酸溶液中,c(H+)之比 |
| C、常温下,氨水与(NH4)2SO4溶液混合后pH=7的溶液中,c(NH4+):c(SO42-) |
| D、液面在“0”刻度时,25mL碱式滴定管和50mL碱式滴定管所盛液体的体积 |
考点:pH的简单计算,弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A.强碱完全电离,pH=12 的溶液中c(OH-)=0.01mol/L;
B.弱酸的浓度越小,电离程度越大;
C.根据电荷守恒及pH=7时c(H+)=c(OH-)来分析;
D.碱式滴定管下端没有刻度的地方有溶液;
B.弱酸的浓度越小,电离程度越大;
C.根据电荷守恒及pH=7时c(H+)=c(OH-)来分析;
D.碱式滴定管下端没有刻度的地方有溶液;
解答:
解:A.强碱完全电离,pH=12 的溶液中c(OH-)=0.01mol/L,c〔(Ba(OH)2〕=0.005mol/L,c(KOH)=0.01mol/L,所以c〔(Ba(OH)2〕:c(KOH)=1:2,故A正确;
B.弱酸的浓度越小,电离程度越大,则相同温度下,0.1mol/L乙酸溶液与0.2mol/L乙酸溶液中,c(H+)之比大于1:2,故B错误;
C.pH=7时c(H+)=c(OH-),由电荷守恒可知c(H+)+c(NH4+)=c(OH-)+2c(SO42-),则c(NH4+)=2c(SO42-),c(NH4+):c(SO42-)=2:1,故C错误;
D.碱式滴定管下端没有刻度的地方有溶液,则液面在“0”刻度时,25mL碱式滴定管和50mL碱式滴定管所盛液体的体积不是1:2,故D错误;
故选A.
B.弱酸的浓度越小,电离程度越大,则相同温度下,0.1mol/L乙酸溶液与0.2mol/L乙酸溶液中,c(H+)之比大于1:2,故B错误;
C.pH=7时c(H+)=c(OH-),由电荷守恒可知c(H+)+c(NH4+)=c(OH-)+2c(SO42-),则c(NH4+)=2c(SO42-),c(NH4+):c(SO42-)=2:1,故C错误;
D.碱式滴定管下端没有刻度的地方有溶液,则液面在“0”刻度时,25mL碱式滴定管和50mL碱式滴定管所盛液体的体积不是1:2,故D错误;
故选A.
点评:本题考查离子浓度的关系,熟悉仪器的结构、电离与浓度的关系、电荷守恒、pH与浓度的关系即可解答,题目难度不大,D碱式滴定管下端没有刻度的地方有溶液为易错点.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
根据陈述的知识,类推得出的结论正确的是( )
| A、HCl的水溶液显酸性,则NH3的水溶液也显酸性 |
| B、常温下铝投入浓硫酸、浓硝酸中都没有气泡产生,则常温下铝投入浓盐酸中也没有气泡产生 |
| C、常温下铝易与氧气反应,则常温下镁也易与氧气反应 |
| D、氧化镁不能溶解在氢氧化钠溶液中,则氧化铝也不能溶解在氢氧化钠溶液中 |
 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴下面的氧气含量比液滴边缘少.下列说法正确的是( )
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴下面的氧气含量比液滴边缘少.下列说法正确的是( )| A、(a)区腐蚀比(b)区腐蚀严重 |
| B、该过程发生了化学反应:4Fe+3O2→2Fe2O3 |
| C、该过程是析氢腐蚀,负极反应为:Fe-2e-→Fe2+ |
| D、该过程为吸氧腐蚀,正极反应为:O2+2H2O+4e-=4OH- |
下列有关阿伏加德罗常数(NA)的说法错误的是( )
| A、32克O2所含的原子数目为2NA |
| B、0.5molSO2含有的原子数目为1.5NA |
| C、0.5molSO2含有的分子数目为1.5NA |
| D、0.5NA个氯气分子(标况下)的体积是11.2L |
 甘油的分离
甘油的分离 如图所示,将铁、铜通过导线相连,置于稀硫酸中.
如图所示,将铁、铜通过导线相连,置于稀硫酸中.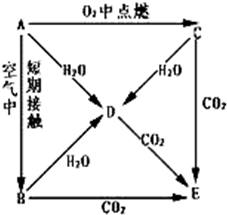 A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按图所示关系相互转化,已知A为单质.
A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按图所示关系相互转化,已知A为单质.