题目内容
 如图所示,将铁、铜通过导线相连,置于稀硫酸中.
如图所示,将铁、铜通过导线相连,置于稀硫酸中.(1)负极电极反应式
(2)正极正极电极反应式
(3)该电池总反应的离子方程式
考点:原电池和电解池的工作原理
专题:电化学专题
分析:该原电池中,Fe易失电子作负极、Cu作正极,负极上电极反应式为Fe-2e-=Fe2+,正极上电极反应式为2H++2e-=H2↑,导致负极上金属逐渐减少,正极上有气泡产生,正负极反应之和即为总反应.
解答:
解:(1)该原电池中,Fe易失电子作负极、Cu作正极,负极上铁失电子发生氧化反应生成亚铁离子进入溶液,电极反应式为Fe-2e-=Fe2+,故答案为:Fe-2e-=Fe2+;
(2)正极上氢离子得电子发生还原反应生成氢气,电极反应式为2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(3)正负极反应之和即为总反应:Fe+2H+=Fe2++H2↑;故答案为:Fe+2H+=Fe2++H2↑.
(2)正极上氢离子得电子发生还原反应生成氢气,电极反应式为2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(3)正负极反应之和即为总反应:Fe+2H+=Fe2++H2↑;故答案为:Fe+2H+=Fe2++H2↑.
点评:本题考查了原电池,明确正负极的判断方法及电极上发生的反应是解本题关键,根据电极反应确定发生的现象,题目难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
在1 100℃,一定容积的密闭容器中发生反应:FeO(s)+CO(g)?Fe(s)+CO2(g)△H=a kJ/mol(a>0),该温度下K=0.263,下列有关该反应的说法正确的是( )
| A、若生成1 mol Fe,则吸收的热量小于akJ |
| B、若要提高CO的转化率,则应该加入适当的过量Fe0 |
| C、若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态 |
| D、达到化学平衡状态时,若c(CO)=0.100 mol/L,则c(CO2)=0.0263 mol/L |
下列叙述中的前后两个量之比为1:2的是( )
| A、相同温度下,pH=12的Ba(OH)2与pH=12的KOH溶液中,c〔(Ba(OH)2〕:c(KOH) |
| B、相同温度下,0.1mol/L乙酸溶液与0.2mol/L乙酸溶液中,c(H+)之比 |
| C、常温下,氨水与(NH4)2SO4溶液混合后pH=7的溶液中,c(NH4+):c(SO42-) |
| D、液面在“0”刻度时,25mL碱式滴定管和50mL碱式滴定管所盛液体的体积 |
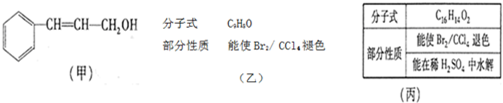
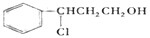
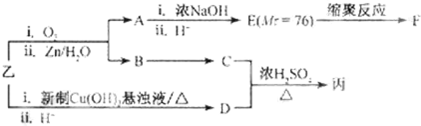
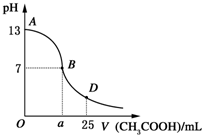 I.如图所示,向25mL 0.1mol?L-1 NaOH溶液中逐滴滴加0.2mol?L-1 CH3COOH溶液过程中溶液pH的变化曲线.请回答:
I.如图所示,向25mL 0.1mol?L-1 NaOH溶液中逐滴滴加0.2mol?L-1 CH3COOH溶液过程中溶液pH的变化曲线.请回答:




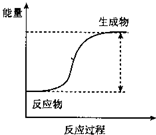 (1)反应的分类研究:从能量变化角度分,将反应分为放热反应和吸热反应.下列反应中能量变化符合如图所示的是
(1)反应的分类研究:从能量变化角度分,将反应分为放热反应和吸热反应.下列反应中能量变化符合如图所示的是 某研究性学习小组的同学设计一套方案,在实验室中制取肥皂(如图为硬脂酸甘油酯在碱性条件下水解的装置图)及甘油.已知酒精的沸点为78.5℃、甘油的沸点为290℃,硬脂酸甘油酯的沸点为260℃.
某研究性学习小组的同学设计一套方案,在实验室中制取肥皂(如图为硬脂酸甘油酯在碱性条件下水解的装置图)及甘油.已知酒精的沸点为78.5℃、甘油的沸点为290℃,硬脂酸甘油酯的沸点为260℃. 用图表示的一些物质或概念间的从属关系不正确的是( )
用图表示的一些物质或概念间的从属关系不正确的是( )