题目内容
根据陈述的知识,类推得出的结论正确的是( )
| A、HCl的水溶液显酸性,则NH3的水溶液也显酸性 |
| B、常温下铝投入浓硫酸、浓硝酸中都没有气泡产生,则常温下铝投入浓盐酸中也没有气泡产生 |
| C、常温下铝易与氧气反应,则常温下镁也易与氧气反应 |
| D、氧化镁不能溶解在氢氧化钠溶液中,则氧化铝也不能溶解在氢氧化钠溶液中 |
考点:氯、溴、碘及其化合物的综合应用,氨的化学性质,铝的化学性质,镁、铝的重要化合物
专题:元素及其化合物
分析:A、NH3的水溶液显碱性;
B、铝在浓硫酸、浓硝酸中钝化,能和浓盐酸反应生成氢气;
C、镁的金属性比铝的强,易于氧气反应;
D、氧化铝为两性氧化物,可以和氢氧化钠反应.
B、铝在浓硫酸、浓硝酸中钝化,能和浓盐酸反应生成氢气;
C、镁的金属性比铝的强,易于氧气反应;
D、氧化铝为两性氧化物,可以和氢氧化钠反应.
解答:
解:A、NH3的水溶液显碱性,与HCl的性质不同,故A错误;
B、铝在浓硫酸、浓硝酸中钝化没有气体生成,但能和浓盐酸反应生成氢气,故B错误;
C、镁的金属性比铝的强,易于氧气发生氧化还原反应,故C正确;
D、氧化铝为两性氧化物,既可以与强酸反应也可以和强碱氢氧化钠反应,故D错误.
故选:C.
B、铝在浓硫酸、浓硝酸中钝化没有气体生成,但能和浓盐酸反应生成氢气,故B错误;
C、镁的金属性比铝的强,易于氧气发生氧化还原反应,故C正确;
D、氧化铝为两性氧化物,既可以与强酸反应也可以和强碱氢氧化钠反应,故D错误.
故选:C.
点评:本题考查较为综合,侧重于基础知识的考查和应用,难度不大,注意物质性质具有规律性,也有独特的性质,不是所有性质都能迁移.

练习册系列答案
相关题目
常温下,向20mL pH=11的氨水中加水稀释,下列说法正确的是( )
A、溶液中c(NH3?H2O)?
| ||||
| B、NH3?H2O的电离程度增大,c(OH-)也增大 | ||||
| C、溶液中导电微粒数目减少 | ||||
| D、再加20mL pH=3的盐酸,混合溶液的pH=7 |
下列叙述中的前后两个量之比为1:2的是( )
| A、相同温度下,pH=12的Ba(OH)2与pH=12的KOH溶液中,c〔(Ba(OH)2〕:c(KOH) |
| B、相同温度下,0.1mol/L乙酸溶液与0.2mol/L乙酸溶液中,c(H+)之比 |
| C、常温下,氨水与(NH4)2SO4溶液混合后pH=7的溶液中,c(NH4+):c(SO42-) |
| D、液面在“0”刻度时,25mL碱式滴定管和50mL碱式滴定管所盛液体的体积 |
常温下,在pH=14的溶液中,能大量共存的一组离子或分子是( )
| A、Mg2+、Ca2+、ClO-、NO3- |
| B、K+、Na+、AlO2-、CO32- |
| C、K+、CO32-、C6H5OH、SO42- |
| D、Na+、K+、Cl-、SO2 |
下列叙述正确的是( )
| A、通常情况下,1.5 mol O2的体积约为33.6 L |
| B、NaOH的摩尔质量是40 g |
| C、在100 mL水中溶解5.85 g NaCl,则所得NaCl溶液的物质的量浓度为1 mol?L-1 |
| D、同温同压下,相同体积的任何气体所含的分子数一定相同 |
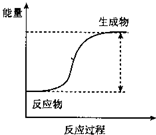 (1)反应的分类研究:从能量变化角度分,将反应分为放热反应和吸热反应.下列反应中能量变化符合如图所示的是
(1)反应的分类研究:从能量变化角度分,将反应分为放热反应和吸热反应.下列反应中能量变化符合如图所示的是
