题目内容
下列实验“操作和现象”与“结论”对应关系正确的是( )
| 操作和现象 | 结论 | |
| A | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体 | HNO3分解生成了NO2 |
| B | 在漂白粉中滴入70%的硫酸,立刻产生黄绿色气体 | 硫酸具有还原性 |
| C | AgI沉淀中滴入稀KCl溶液,有白色沉淀出现 | AgCl比AgI更难溶 |
| D | 向饱和Na2CO3中通入足量CO2,溶液变浑浊 | 析出了NaHCO3 |
| A、A | B、B | C、C | D、D |
考点:化学实验方案的评价
专题:实验评价题
分析:A.NO3-在酸性条件下具有氧化性,被还原生成NO,NO被O2氧化为红棕色的NO2;
B.酸性条件下,Ca(ClO)2和CaCl2发生氧化还原反应生成氯气;
C.c(Cl-)×c(Ag+)>Ksp(AgCl),则生成沉淀;
D.相同温度、溶剂下,碳酸氢钠的溶解度小于碳酸钠的溶解度.
B.酸性条件下,Ca(ClO)2和CaCl2发生氧化还原反应生成氯气;
C.c(Cl-)×c(Ag+)>Ksp(AgCl),则生成沉淀;
D.相同温度、溶剂下,碳酸氢钠的溶解度小于碳酸钠的溶解度.
解答:
解:A.向Fe(NO3)2溶液中加入H2SO4,则会发生离子反应:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,产生的NO在管口生成NO2呈现红色,而不是HNO3分解产生NO2,故A错误;
B.酸性条件下,Ca(ClO)2和CaCl2发生氧化还原反应生成氯气,硫酸化合价不发生变化,故B错误;
C.AgI沉淀中滴入稀KCl溶液,若c(Cl-)×c(Ag+)>Ksp(AgCl),则生成白色沉淀,但AgI比AgCl更难溶,故C错误;
D.饱和Na2CO3溶液中通入CO2发生反应:Na2CO3+CO2+H2O=2NaHCO3,由于产生的碳酸氢钠溶解度小于碳酸钠,故会从过饱和溶液中析出,故D正确.
故选D.
B.酸性条件下,Ca(ClO)2和CaCl2发生氧化还原反应生成氯气,硫酸化合价不发生变化,故B错误;
C.AgI沉淀中滴入稀KCl溶液,若c(Cl-)×c(Ag+)>Ksp(AgCl),则生成白色沉淀,但AgI比AgCl更难溶,故C错误;
D.饱和Na2CO3溶液中通入CO2发生反应:Na2CO3+CO2+H2O=2NaHCO3,由于产生的碳酸氢钠溶解度小于碳酸钠,故会从过饱和溶液中析出,故D正确.
故选D.
点评:本题考查化学实验方案的评价,注意物质的性质和物质的检验方法,排除其它因素的干扰,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列叙述中的前后两个量之比为1:2的是( )
| A、相同温度下,pH=12的Ba(OH)2与pH=12的KOH溶液中,c〔(Ba(OH)2〕:c(KOH) |
| B、相同温度下,0.1mol/L乙酸溶液与0.2mol/L乙酸溶液中,c(H+)之比 |
| C、常温下,氨水与(NH4)2SO4溶液混合后pH=7的溶液中,c(NH4+):c(SO42-) |
| D、液面在“0”刻度时,25mL碱式滴定管和50mL碱式滴定管所盛液体的体积 |
常温下,在pH=14的溶液中,能大量共存的一组离子或分子是( )
| A、Mg2+、Ca2+、ClO-、NO3- |
| B、K+、Na+、AlO2-、CO32- |
| C、K+、CO32-、C6H5OH、SO42- |
| D、Na+、K+、Cl-、SO2 |
09年是勒夏特列诞生189周年下列事实中,不能用勒夏特列原理解释的是( )
| A、在FeSO4溶液中加入少量铁粉以防止Fe2+被氧化 |
| B、合成氨工业上,采用高压以提高NH3的产率 |
| C、实验室中常用排饱和食盐水的方法收集Cl2 |
| D、工业生产硫酸的过程中使用过量的空气以提高SO2的利用率 |
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl-和SO42-的速率如图所示.关于该反应的叙述错误的是( )

| A、氯酸根的氧化性强于硫酸根 |
| B、该反应的速率可能与氢离子浓度有关 |
| C、反应后阶段速率变慢是因为氯酸钾和亚硫酸氢钠浓度越来越小 |
| D、该反应的离子方程式为:ClO5-+3HSO3-+3OH-→3SO42-+Cl-+3H2O |
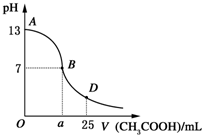 I.如图所示,向25mL 0.1mol?L-1 NaOH溶液中逐滴滴加0.2mol?L-1 CH3COOH溶液过程中溶液pH的变化曲线.请回答:
I.如图所示,向25mL 0.1mol?L-1 NaOH溶液中逐滴滴加0.2mol?L-1 CH3COOH溶液过程中溶液pH的变化曲线.请回答:
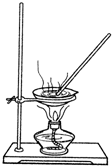 某研究性学习小组的同学设计一套方案,在实验室中制取肥皂(如图为硬脂酸甘油酯在碱性条件下水解的装置图)及甘油.已知酒精的沸点为78.5℃、甘油的沸点为290℃,硬脂酸甘油酯的沸点为260℃.
某研究性学习小组的同学设计一套方案,在实验室中制取肥皂(如图为硬脂酸甘油酯在碱性条件下水解的装置图)及甘油.已知酒精的沸点为78.5℃、甘油的沸点为290℃,硬脂酸甘油酯的沸点为260℃. 用图表示的一些物质或概念间的从属关系不正确的是( )
用图表示的一些物质或概念间的从属关系不正确的是( )