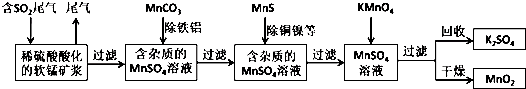
题目内容
4.设阿伏加德罗常数的值为NA,下列说法正确的是( )| A. | 1 mol Na2O2晶体中含有的阴离子数目为2NA | |
| B. | 1 mol Na2O2与足量CO2反应时,转移2NA个电子 | |
| C. | 1 mol•L-1的NaOH溶液中含Na+数目为NA | |
| D. | 1 mol钠与足量氧气反应生成Na2O或Na2O2时,失电子数目均为NA |
分析 A、过氧化钠由2个钠离子和1个过氧根构成;
B、过氧化钠与二氧化碳的反应为歧化反应;
C、溶液体积不明确;
D、钠反应后变为+1价.
解答 解:A、过氧化钠由2个钠离子和1个过氧根构成,故1mol过氧化钠中含1mol阴离子即NA个,故A错误;
B、过氧化钠与二氧化碳的反应为歧化反应,故1ol过氧化钠转移1mol电子即NA个,故B错误;
C、溶液体积不明确,故溶液中的钠离子的个数无法计算,故C错误;
D、钠反应后变为+1价,故1mol金属钠反应后失去1mol电子即NA个,与产物种类无关,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.T℃时,将足量的BaSO4固体溶于一定量水中达到溶解平衡后,假定溶液体积不变的情况下,加入Na2CO3使c(CO32-)增大过程中,溶液中c(Ba2+)和c(SO42-)的变化曲线如图所示.则下列说法错误的是( )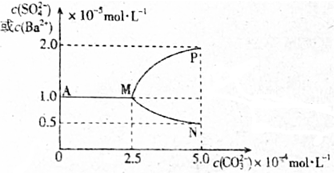

| A. | T℃时Ksp(BaSO4)<Ksp(BaCO3) | |
| B. | 当c(CO32-)大于2.5×10-4mol•L-1时开始有BaCO3沉淀生成 | |
| C. | 图象中代表沉淀转化过程中c(Ba2+)随c(CO32-)变化的曲线是MP | |
| D. | 反应BaSO4(s)+CO32-(aq)?BaCO3(s)+SO42-(aq)的平衡常数K=0.04 |
15.I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq),某I2、KI混合溶液中,c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法不正确的是( )

| A. | 反应I2(aq)+I-(aq)?I3-(aq)△H<0 | |
| B. | 温度为T1时,向该平衡体系中加入KI固体,平衡不移动 | |
| C. | 若T1时,反应进行到状态d时,一定有v正>v逆 | |
| D. | 状态a与状态b相比,状态b时I2的转化率更低 |
19.在酸性高锰酸钾溶液中加入Na2O2粉末,高锰酸钾溶液褪色,其中发生反应的离子方程式为:2MnO4-+16H++5Na2O2═2Mn2++5O2↑+8H2O+10Na+下列判断正确的是( )
| A. | 高锰酸钾是氧化剂,Na2O2既是氧化剂,又是还原剂 | |
| B. | 反应的氧化产物只有氧气 | |
| C. | 当反应产生标准状况下2.24 L O2 时,反应转移的电子为0.1mol | |
| D. | 通常所说的酸化的高锰酸钾溶液是指滴加了浓盐酸的高锰酸钾溶液 |
16.化学与社会、生活密切相关,下列说法正确的是( )
| A. | “歼-20”飞机上使用的碳纤维是一种新型的有机高分子材料 | |
| B. | 工业上通常用电解Na、Mg、Al对应的氯化物制取该三种金属单质 | |
| C. | 石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化 | |
| D. | 燃料电池的燃料都在负极发生氧化反应 |
13.将32g Cu与150mL一定浓度的HNO3恰好反应,Cu完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L.则下列各项中正确的是( )
| A. | 所用HNO3为浓度为10mol/L | B. | NO的体积为6.72升 | ||
| C. | NO2的体积为3.36升 | D. | 被还原的HNO3为1mol |
14.已知H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ•mol-1,则反应HCl(g)═$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)的△H为( )
| A. | +184.6kJ•mol-1 | B. | -92.3kJ•mol-1 | C. | -69.2kJ•mol-1 | D. | +92.3kJ•mol-1 |