题目内容
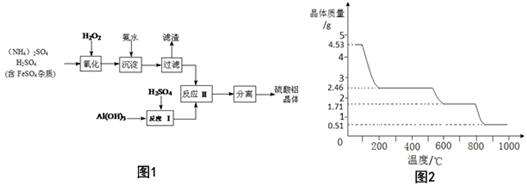
15.I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq),某I2、KI混合溶液中,c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法不正确的是( )
| A. | 反应I2(aq)+I-(aq)?I3-(aq)△H<0 | |
| B. | 温度为T1时,向该平衡体系中加入KI固体,平衡不移动 | |
| C. | 若T1时,反应进行到状态d时,一定有v正>v逆 | |
| D. | 状态a与状态b相比,状态b时I2的转化率更低 |
分析 由图象曲线的变化趋势可知,当温度升高时,I3-的物质的量浓度减小,说明该反应的正反应为放热反应,升高温度,平衡向逆反应方向移动,温度越高,平衡常数越小,从温度对平衡移动的影响分析不同状态的A的浓度大小.
解答 解:A.由图象曲线的变化趋势可知,当温度升高时,I3-的物质的量浓度减小,说明该反应的正反应为放热反应,反应I2(aq)+I-(aq)?I3-(aq)的△H<0,故A正确;
B.温度为T1时,向该平衡体系中加入KI固体,KI溶于水,c(I-)增大,平衡向正反应方向移动,故B错误;
C.若反应进行到状态d时,反应未达到平衡状态,若反应趋向于平衡,则反应向生成的I3-方向移动,则v正>v逆,故C正确;
D.状态a与状态b相比,b状态相当于在a的基础上升高温度,平衡向逆反应方向移动,状态b时I2的转化率减小,故D正确;
故选B.
点评 本题考查化学平衡移动图象问题,题目难度不大,注意分析化学方程式的特征以及温度、压强对平衡移动的影响.

练习册系列答案
 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
6.在下列溶液中,各组离子一定能够大量共存的是( )
| A. | 25℃由水电离的c(H+)=10-12mol/L 的溶液:Fe3+ Cl- NO3- K+ | |
| B. | 使酚酞变红的溶液:Na+ Cl- SO42-AlO2- | |
| C. | 某无色溶液:HCO3- NO3- Al3+ Ba2+ | |
| D. | 25℃时,pH=1的溶液:Ba2+ NO3- K+ I- |
3.“纳米材料”是粒子直径为1~100nm的材料,纳米碳就是其中一种,若将纳米碳均匀地分散到蒸馏水中,所形成的体系( )
①是溶液 ②是胶体 ③能产生丁达尔效应 ④静置后会析出黑色沉淀.
①是溶液 ②是胶体 ③能产生丁达尔效应 ④静置后会析出黑色沉淀.
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
20.二甲醚(CH3OCH3)被称为21世纪的清洁、高效能源.
I、(1)合成二甲醚反应一:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-247KJ/mol
一定条件下该反应在密闭容器中达到平衡后,既要加快反应速率又要提高H2的转化率,可以采取的措施是D.
A、低温 B、加催化剂 C、体积不变充入N2
D、增加CO浓度 E、分离出二甲醚
(2)保持其它条件不变,只改变下列条件能使H2的体积分数增大的是C.
A.使用高效催化剂 B.增大压强
C.升高温度 D.向容器中再充入1mol (CH3OCH3)和1molCO2
(3)在一定温度下,可以判断该分解反应已经达到化学平衡的是ABD.
A.V正(CO)﹕V逆(CO2)=3﹕1B.恒容密闭容器中总压强不变
C.恒容密闭容器中混合气体的密度不变D.密闭容器中氢气的体积分数不变
(4)合成二甲醚反应二:2CH3OH(g)?CH3OCH3(g)+H2O(g).在不同温度下,分别在1L密闭容器中加入不同物质的量的CH3OH,反应达到平衡,测得各组分的浓度如表:‘
403K时,该反应的平衡常数为400
Ⅱ、二甲醚燃料电池的工作原理如图一所示.
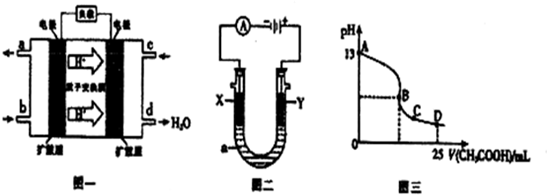
(1)该电池负极的电极反应式为CH3OCH3+3H2O-12e-=12H++2CO2.
(2)以上述电池为电源,通过导线与图二电解池相连.X、Y为石墨,a为1L0.1mol/LKCl溶液,两极共产生0.224L(标准状况下)气体时,溶液的pH为12.(忽略溶液的体积变化)
(3)室温时,按上述(2)电解一段时间后,取25mL上述电解后溶液,滴加0.2mol/L 醋酸得到图三(不考虑能量损失和气体溶于水,溶液体积变化忽略不计).
①若图三的B点pH=7,则滴定终点在AB区间(填“AB”、“BC”或“CD”).
②C点溶液中各离子浓度大小关系是c(CH3COO-)>c(K+)>c(H+)>c(OH-).
I、(1)合成二甲醚反应一:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-247KJ/mol
一定条件下该反应在密闭容器中达到平衡后,既要加快反应速率又要提高H2的转化率,可以采取的措施是D.
A、低温 B、加催化剂 C、体积不变充入N2
D、增加CO浓度 E、分离出二甲醚
(2)保持其它条件不变,只改变下列条件能使H2的体积分数增大的是C.
A.使用高效催化剂 B.增大压强
C.升高温度 D.向容器中再充入1mol (CH3OCH3)和1molCO2
(3)在一定温度下,可以判断该分解反应已经达到化学平衡的是ABD.
A.V正(CO)﹕V逆(CO2)=3﹕1B.恒容密闭容器中总压强不变
C.恒容密闭容器中混合气体的密度不变D.密闭容器中氢气的体积分数不变
(4)合成二甲醚反应二:2CH3OH(g)?CH3OCH3(g)+H2O(g).在不同温度下,分别在1L密闭容器中加入不同物质的量的CH3OH,反应达到平衡,测得各组分的浓度如表:‘
| 实验组 | 温度/K | 平衡浓度mol/L | ||
| CH3OH | CH3OCH3 | H2O | ||
| l | 403 | 0.01 | 0.2 | 0.2 |
| 2 | 453 | 0.02 | 0.3 | 0.4 |
Ⅱ、二甲醚燃料电池的工作原理如图一所示.

(1)该电池负极的电极反应式为CH3OCH3+3H2O-12e-=12H++2CO2.
(2)以上述电池为电源,通过导线与图二电解池相连.X、Y为石墨,a为1L0.1mol/LKCl溶液,两极共产生0.224L(标准状况下)气体时,溶液的pH为12.(忽略溶液的体积变化)
(3)室温时,按上述(2)电解一段时间后,取25mL上述电解后溶液,滴加0.2mol/L 醋酸得到图三(不考虑能量损失和气体溶于水,溶液体积变化忽略不计).
①若图三的B点pH=7,则滴定终点在AB区间(填“AB”、“BC”或“CD”).
②C点溶液中各离子浓度大小关系是c(CH3COO-)>c(K+)>c(H+)>c(OH-).
4.设阿伏加德罗常数的值为NA,下列说法正确的是( )
| A. | 1 mol Na2O2晶体中含有的阴离子数目为2NA | |
| B. | 1 mol Na2O2与足量CO2反应时,转移2NA个电子 | |
| C. | 1 mol•L-1的NaOH溶液中含Na+数目为NA | |
| D. | 1 mol钠与足量氧气反应生成Na2O或Na2O2时,失电子数目均为NA |
5.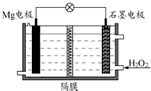 Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液(加入一定量酸),示意图如图.该电池工作时,下列说法正确的是( )
Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液(加入一定量酸),示意图如图.该电池工作时,下列说法正确的是( )
 Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液(加入一定量酸),示意图如图.该电池工作时,下列说法正确的是( )
Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液(加入一定量酸),示意图如图.该电池工作时,下列说法正确的是( )| A. | 电池工作时,石墨周围海水的pH减少 | |
| B. | 电池工作时,溶液中的H+向负极移动 | |
| C. | 电池总反应为Mg+H2O2+2H+═Mg2++2H2O | |
| D. | Mg电极是该电池的正极 |