题目内容
12.污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题.某化学研究小组利用软锰矿(主要成分为MnO2,另含有少量头铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已略去).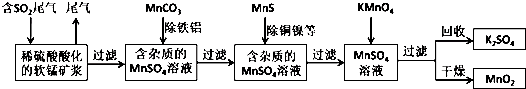
请回答下列问题:
(1)上述流程脱硫实现了A、C(选填下列字母编号).
A.废弃物的综合利用 B.白色污染的减少 C.酸雨的减少
(2)用MnCO3能除去溶液中Al3+和Fe3+,其原因是消耗溶液中的酸,促进Al3+和Fe3+水解生成氢氧化物沉淀.
(3)已知:25℃、101kpa时,Mn(s)+O2(g)═MnO2(s)△H=-520kJ/mol
S(s)+O2(g)═SO2(g)△H=-297kJ/mol
Mn(s)+S(s)+2O2(g)═MnSO4(s)△H=-1065kJ/mol
SO2与MnO2反应生成无水MnSO4的热化学方程式是MnO2(s)+SO2(g)=MnSO4(s)△H=-248kJ/mol.
(4)MnO2可作超级电容器材料.用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是Mn2++2H2O-2e-=MnO2+4H+.
(5)MnO2是碱性锌锰电池的正极材料.碱性锌锰电池放电时,正极的电极反应式是MnO2+H2O+e-=MnO(OH)+OH-.
(6)假设脱除的SO2只与软锰矿浆中的MnO2反应.按照图示流程,将a m3(标准状况)含SO2的体积分数为b%的尾气通入矿浆,若SO2的脱除率为89.6%,最终得到MnO2的质量为c kg,则除去铁、铝、铜、镍等杂质时,所引入的锰元素相当于MnO2$\frac{1500c-87ab}{2500}$kg.
分析 由流程可知,二氧化硫能与二氧化锰反应生成硫酸锰,用MnCO3能除去溶液中Al3+和Fe3+,MnS将铜、镍离子还原为单质,高锰酸钾能与硫酸锰反应生成二氧化锰,通过过滤获得二氧化锰,
(1)脱硫能减少酸雨;
(2)MnCO3消耗溶液中的酸,促进Al3+和Fe3+水解;
(3)根据盖斯定律解题,Mn(s)+O2(g)═MnO2(s)△H=-520kJ•mol-1
S(s)+O2(g)═SO2(g)△H=-297kJ•mol-1
Mn(s)+S(s)+2O2(g)═MnSO4(s)△H=-1065kJ•mol-1
将③-②-①可得;
(4)锰离子在阳极失电子生成二氧化锰;
(5)二氧化锰得电子碱溶液中生成MnO(OH);
(6)SO2+MnO2=MnSO4,根据方程式结合元素守恒解题,反应的二氧化硫的物质的量为 $\frac{a×1000}{22.4}$×b%×89.6%=0.4abmol,根据SO2+MnO2=MnSO4可知生成硫酸锰的物质的量为0.4abmol,最终生成的二氧化锰为c kg.
解答 解:(1)脱硫能减少酸雨和废物在利用,白色污染的减少是塑料的减少和流程无关,
故答案为:AC;
(2)MnCO3消耗溶液中的酸,促进Al3+和Fe3+水解生成氢氧化物沉淀,
故答案为:消耗溶液中的酸,促进Al3+和Fe3+水解生成氢氧化物沉淀;
(3)Mn(s)+O2(g)═MnO2(s)△H=-520kJ•mol-1
S(s)+O2(g)═SO2(g)△H=-297kJ•mol-1
Mn(s)+S(s)+2O2(g)═MnSO4(s)△H=-1065kJ•mol-1
将③-②-①可得MnO2(s)+SO2(g)=MnSO4(s)△H=-248kJ/mol,
故答案为:MnO2(s)+SO2(g)=MnSO4(s)△H=-248kJ/mol;
(4)锰离子在阳极失电子:Mn2++2H2O-2e-=MnO2+4H+,
故答案为:Mn2++2H2O-2e-=MnO2+4H+;
(5)二氧化锰得电子生成MnO(OH),MnO2+H2O+e-=MnO(OH)+OH-,
故答案为:MnO2+H2O+e-=MnO(OH)+OH-;
(6)反应的二氧化硫的物质的量为 $\frac{a×1000}{22.4}$×b%×89.6%=0.4abmol,根据SO2+MnO2=MnSO4可知生成硫酸锰的物质的量为0.4abmol,最终生成的二氧化锰为c kg,设消耗硫酸锰的物质的量为x,
2KMnO4+3MnSO4+2H2O═5MnO2+2H2SO4+K2SO4
3 87×5
x 1000c
x=$\frac{3000c}{435}$
除去铁、铝、铜、镍等杂质时,所引入的锰元素($\frac{3000c}{435}$-0.4ab)mol,
相当于MnO2的质量($\frac{3000c}{435}$-0.4ab)mol×87g/mol=(600c-0.4ab×87)g=$\frac{1500c-87ab}{2500}$kg,
故答案为:$\frac{1500c-87ab}{2500}$.
点评 本题考查热化学方程式、原电池、电解池和化学计算等,侧重于学生的分析能力和实验能力的考查,难度中等.

 名校课堂系列答案
名校课堂系列答案①是溶液 ②是胶体 ③能产生丁达尔效应 ④静置后会析出黑色沉淀.
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
I、(1)合成二甲醚反应一:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-247KJ/mol
一定条件下该反应在密闭容器中达到平衡后,既要加快反应速率又要提高H2的转化率,可以采取的措施是D.
A、低温 B、加催化剂 C、体积不变充入N2
D、增加CO浓度 E、分离出二甲醚
(2)保持其它条件不变,只改变下列条件能使H2的体积分数增大的是C.
A.使用高效催化剂 B.增大压强
C.升高温度 D.向容器中再充入1mol (CH3OCH3)和1molCO2
(3)在一定温度下,可以判断该分解反应已经达到化学平衡的是ABD.
A.V正(CO)﹕V逆(CO2)=3﹕1B.恒容密闭容器中总压强不变
C.恒容密闭容器中混合气体的密度不变D.密闭容器中氢气的体积分数不变
(4)合成二甲醚反应二:2CH3OH(g)?CH3OCH3(g)+H2O(g).在不同温度下,分别在1L密闭容器中加入不同物质的量的CH3OH,反应达到平衡,测得各组分的浓度如表:‘
| 实验组 | 温度/K | 平衡浓度mol/L | ||
| CH3OH | CH3OCH3 | H2O | ||
| l | 403 | 0.01 | 0.2 | 0.2 |
| 2 | 453 | 0.02 | 0.3 | 0.4 |
Ⅱ、二甲醚燃料电池的工作原理如图一所示.
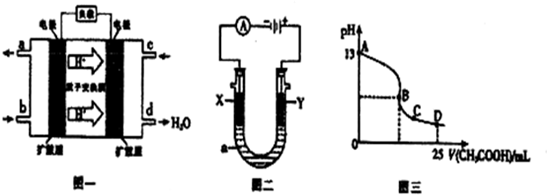
(1)该电池负极的电极反应式为CH3OCH3+3H2O-12e-=12H++2CO2.
(2)以上述电池为电源,通过导线与图二电解池相连.X、Y为石墨,a为1L0.1mol/LKCl溶液,两极共产生0.224L(标准状况下)气体时,溶液的pH为12.(忽略溶液的体积变化)
(3)室温时,按上述(2)电解一段时间后,取25mL上述电解后溶液,滴加0.2mol/L 醋酸得到图三(不考虑能量损失和气体溶于水,溶液体积变化忽略不计).
①若图三的B点pH=7,则滴定终点在AB区间(填“AB”、“BC”或“CD”).
②C点溶液中各离子浓度大小关系是c(CH3COO-)>c(K+)>c(H+)>c(OH-).
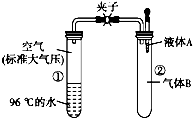 如图所示,夹子开始处于关闭状态,将液体A滴入试管②中,一段时间后打开夹子,可发现试管①内的水立刻沸腾 了.(已知,气压减小,水的沸点降低)则液体A和气体B的组合不可能是下列的( )
如图所示,夹子开始处于关闭状态,将液体A滴入试管②中,一段时间后打开夹子,可发现试管①内的水立刻沸腾 了.(已知,气压减小,水的沸点降低)则液体A和气体B的组合不可能是下列的( )| A. | 氢氧化钠溶液、二氧化碳 | B. | 饱和食盐水、氯化氢 | ||
| C. | 氢氧化钠溶液、一氧化碳 | D. | 石灰水、二氧化硫 |
| A. | 1 mol Na2O2晶体中含有的阴离子数目为2NA | |
| B. | 1 mol Na2O2与足量CO2反应时,转移2NA个电子 | |
| C. | 1 mol•L-1的NaOH溶液中含Na+数目为NA | |
| D. | 1 mol钠与足量氧气反应生成Na2O或Na2O2时,失电子数目均为NA |
| A. | 1 mol乙酸在浓H2SO4存在下与足量乙醇反应可得1 mol乙酸乙酯 | |
| B. | 对苯二甲酸(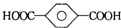 ) 与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维 ( ) 与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维 (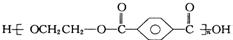 ) ) | |
| C. | 分子式为C5H12O的醇,能在铜催化下被O2氧化为醛的同分异构体有4种 | |
| D. |  分子中的所有原子有可能共平面 分子中的所有原子有可能共平面 |
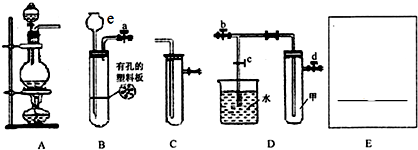
 某化学研究性学习小组探究Fe3+和SO32-之间发生的反应.
某化学研究性学习小组探究Fe3+和SO32-之间发生的反应.