题目内容
14.T℃时,将足量的BaSO4固体溶于一定量水中达到溶解平衡后,假定溶液体积不变的情况下,加入Na2CO3使c(CO32-)增大过程中,溶液中c(Ba2+)和c(SO42-)的变化曲线如图所示.则下列说法错误的是( )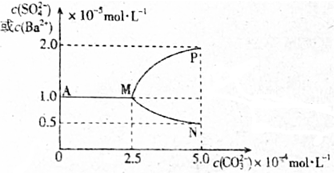
| A. | T℃时Ksp(BaSO4)<Ksp(BaCO3) | |
| B. | 当c(CO32-)大于2.5×10-4mol•L-1时开始有BaCO3沉淀生成 | |
| C. | 图象中代表沉淀转化过程中c(Ba2+)随c(CO32-)变化的曲线是MP | |
| D. | 反应BaSO4(s)+CO32-(aq)?BaCO3(s)+SO42-(aq)的平衡常数K=0.04 |
分析 在硫酸钡饱和溶液中加入Na2CO3,发生沉淀的转化:BaSO4 (s)+CO32- (aq)?BaCO3 (s)+SO42- (aq),由图象可知,当生成BaCO3沉淀时,促进BaSO4的电离,溶液中c(SO42-)增大,c(Ba2+)减小,则MP为c(SO42-)的变化曲线,MN为c(Ba2+)的变化曲线,由题给图象数据可知Ksp(BaSO4)=1×10-5×1×10-5=1.1×10-10,Ksp(BaCO3)=c(Ba2+)×c(CO32-)=0.5×10-5×5×10-4=2.5×10-9,以此解答该题.
解答 解:A.由题给图象数据可知Ksp(BaSO4)=1×10-5×1×10-5=1.1×10-10,Ksp(BaCO3)=c(Ba2+)×c(CO32-)=0.5×10-5×5×10-4=2.5×10-9,则T℃时Ksp(BaSO4)<Ksp(BaCO3),故A正确;
B.由图象可知当c(CO32-)大于2.5×10-4mol•L-1时,c(SO42-)增大,说明开始有BaCO3沉淀生成,故B正确;
C.当生成BaCO3沉淀时,促进BaSO4的电离,溶液中c(SO42-)增大,c(Ba2+)减小,则MP为c(SO42-)的变化曲线,MN为c(Ba2+)的变化曲线,故C错误;
D.反应BaSO4(s)+CO32-(aq)?BaCO3(s)+SO42-(aq)的平衡常数K=$\frac{Ksp(BaS{O}_{4})}{Ksp(BaC{O}_{3})}$=$\frac{1×1{0}^{-10}}{2.5×1{0}^{-9}}$=0.04,故D正确.
故选C.
点评 本题考查难溶电解质的相关计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握相关计算公式的运用即可解答该题,难度不大.

| A. | C | B. | Si | C. | S | D. | Cl |
| A. | 制氧气时,用Na2O2或H2O2作反应物选择相同的气体发生装置 | |
| B. | 制氯气时,用饱和NaHCO3溶液和浓硫酸净化和干燥气体 | |
| C. | 制氢气时,用浓硫酸与锌反应比用稀硫酸快 | |
| D. | 制二氧化氮时,用水或NaOH溶液吸收尾气 |
| A. | 平衡常数的大小与温度、浓度、压强、催化剂等有关 | |
| B. | Ksp(AgCl)>Ksp(AgI),由此可以判断AgCl(s)+I-(aq)?AgI(s)+Cl-(aq)能够发生 | |
| C. | 当温度升高时,弱酸的电离平衡常数Ka变小 | |
| D. | 化学平衡常数不变时,说明化学反应已达化学平衡状态 |
| A. | 25℃由水电离的c(H+)=10-12mol/L 的溶液:Fe3+ Cl- NO3- K+ | |
| B. | 使酚酞变红的溶液:Na+ Cl- SO42-AlO2- | |
| C. | 某无色溶液:HCO3- NO3- Al3+ Ba2+ | |
| D. | 25℃时,pH=1的溶液:Ba2+ NO3- K+ I- |
①是溶液 ②是胶体 ③能产生丁达尔效应 ④静置后会析出黑色沉淀.
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
| A. | 1 mol Na2O2晶体中含有的阴离子数目为2NA | |
| B. | 1 mol Na2O2与足量CO2反应时,转移2NA个电子 | |
| C. | 1 mol•L-1的NaOH溶液中含Na+数目为NA | |
| D. | 1 mol钠与足量氧气反应生成Na2O或Na2O2时,失电子数目均为NA |