题目内容
19.下列离子方程式的书写不正确的是( )| A. | 氧化铝与盐酸反应:Al2O3+6H+═2Al3++3H2O | |
| B. | 氢氧化铝与NaOH溶液反应:Al(OH)3+OH-═AlO2-+2H2O | |
| C. | 向AlCl3溶液中滴加氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | 向AlCl3溶液中加入过量NaOH溶液:Al3++4OH-═AlO2-+2H2O |
分析 A.反应生成氯化铝和水;
B.反应生成偏铝酸钠和水;
C.反应生成氢氧化铝,一水合氨在离子反应中保留化学式;
D.反应生成氯化钠、偏铝酸钠、水.
解答 解:A.氧化铝与盐酸反应的离子反应为Al2O3+6H+═2Al3++3H2O,故A正确;
B.氢氧化铝与NaOH溶液反应的离子反应为Al(OH)3+OH-═AlO2-+2H2O,故B正确;
C.向AlCl3溶液中滴加氨水的离子反应为Al3++3NH3.H2O═Al(OH)3↓+3NH4+,故C错误;
D.向AlCl3溶液中加入过量NaOH溶液的离子反应为Al3++4OH-═AlO2-+2H2O,故D正确;
故选C.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意保留化学式的物质,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.已知25℃时同浓度的NaClO、NaCN、NaHCO3、CH3COONa四种溶液pH一次减小,则下列四种酸中酸性最强的是( )
| A. | CH3COOH | B. | H2CO3 | C. | HCN | D. | HClO |
14.下列离子方程式正确的是( )
| A. | 稀硝酸与氢氧化钾溶液反应:H++OH-=H2O | |
| B. | 铝与稀盐酸反应:Al+2H+=Al3++H2↑ | |
| C. | 三氯化铁溶液与氢氧化钠溶液反应:FeCl3+3OH-=Fe(OH)3↓+3Cl- | |
| D. | 足量二氧化碳与澄清石灰水反应:CO2+2OH-=CO32-+H2O |
4.表是稀硫酸与某金属反应的实验数据:
(1)实验4和5表明,固体反应物的表面积对反应速率有影响;
(2)仅表明反应物浓度对反应速率产生影响的实验有1、3、4、6、8或2、5(填实验序号);
(3)本实验中影响反应速率的其他因素还有反应温度,
(4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因:因为所有反应中,金属质量和硫酸溶液体积均相等,且硫酸过量,产生热量相等,故溶液温度变化值相近.
| 序号 | 金属质量 g | 金属状态 | c(H2SO4) mol•L-1 | V(H2SO4) mL | 溶液温度/℃ | 金属消失的 时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 30 | 44 | 40 |
(2)仅表明反应物浓度对反应速率产生影响的实验有1、3、4、6、8或2、5(填实验序号);
(3)本实验中影响反应速率的其他因素还有反应温度,
(4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因:因为所有反应中,金属质量和硫酸溶液体积均相等,且硫酸过量,产生热量相等,故溶液温度变化值相近.
11.化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
| A. | 电解NaCl饱和溶液,可制得金属钠 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | 寻找高效催化剂,利用太阳能分解水是制取氢气的较理想方法 | |
| D. | MgO的熔点很高,可用于制作耐高温材料 |
8.在MnO2+4HCl═MnCl2+Cl2↑+2H2O 反应中氧化剂与还原剂分子数之比为( )
| A. | 1:4 | B. | 1:2 | C. | 2:1 | D. | 1:1 |
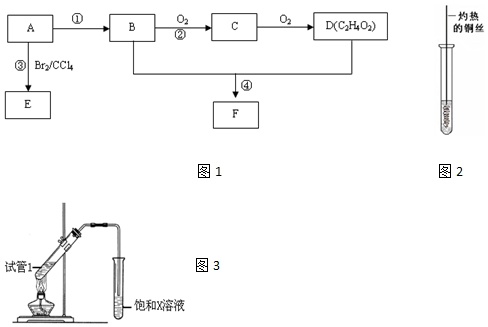
 ,D中官能团为羧基(-COOH).
,D中官能团为羧基(-COOH). CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.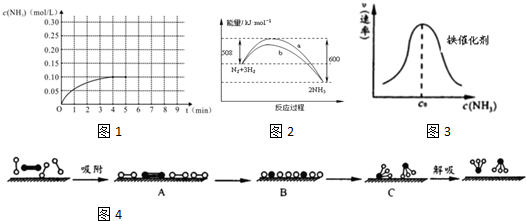
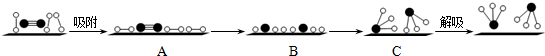
 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图4表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图4表示: