题目内容
5.1902年德国化学家哈伯研究出合成氨的方法,其反应原理为:N2(g)+3H2(g)?2NH3(g);△H(△H<0)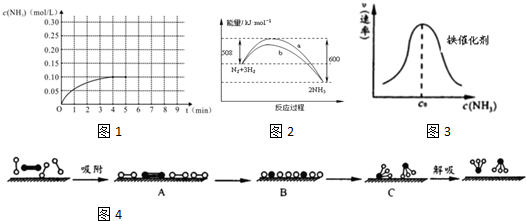
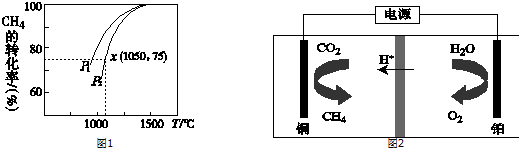
(1)在一容积为4L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生反应,反应中NH3的物质的量浓度变化情况如图1:
①根据图1,计算从反应开始到平衡时,平均反应速率v(H2)为0.0375mol/(L•min).
②反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为AC.
A. 0.20mol/L B. 0.12mol/L C. 0.10mol/L D. 0.08mol/L
(2)某温度时,N2与H2反应过程中的能量变化如图2所示. 下列叙述正确的是AB
A.b曲线是加入催化剂时的能量变化曲线
B.在密闭容器中加入1mol N2、3mol H2,充分反应放出的热量小于92kJ
C.由图可知,断开1mol 氮氮三键与1mol 氢氢键吸收的能量和小于形成1mol 氮氢键所放出的能量
D.反应物的总能量低于生成物的能量
(3)哈伯因证实N2、H2在固体催化剂(Fe)表面吸附和解吸以合成氨的过程而获诺贝尔奖.若用
 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图4表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图4表示: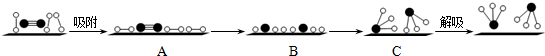
①吸附后,能量状态最低的是C(填字母序号).
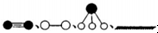
②由上述原理,在铁表面进行NH3的分解实验,发现分解速率与浓度关系如图3.从吸附和解吸过程分析,c0前速率增加的原因可能是氨的浓度增加,催化剂表面吸附的氨分子增多,速率增大;c0后速率降低的原因可能是达到一定浓度后,氨分子浓度太大阻碍N2和H2的解吸.
(4)已知液氨中存在:2NH3(l)?NH2-+NH4+.用Pt电极对液氨进行电解也可产生H2和N2.阴极的电极反应式是2NH3+2e-=H2+2NH2-或2NH4++2e-=H2↑+2NH3.
分析 (1)①结合v=$\frac{△c}{△t}$及速率之比等于化学计量数之比分析;
②合成氨反应为可逆反应,且为放热反应,5min时降低温度平衡正向移动;
(2)A.催化剂降低反应需要的活化能;
B.可逆反应不能完全转化;
C.该反应为放热反应,焓变等于断键吸收的能量减去成键释放的能量;
D.反应为放热反应,反应物的总能量大;
(3)化学键的断裂要吸收能量,故活化状态B的能量高于初始状态A的能量,结合放热反应分析;浓度增大,反应速率加快,但达到一定浓度后,氨分子浓度太大阻碍N2和H2的解吸;
(4)阴极上液氨得到电子发射还原反应生成氢气.
解答 解:(1)①根据图象分析,平衡时氨气的浓度为0.1mol/L,时间为4分钟,所以依据反应速率比等于化学计量数比得到氢气的反应速率=$\frac{3}{2}$×$\frac{0.1mol/L}{4min}$=0.0375 mol/(L•min),故答案为:0.0375;
②该反应为可逆反应,反应物不可能完全转化,则氨气的物质的量浓度不可能为0.2mol/L,温度改变平衡一定发生移动,则氨气的物质的量浓度不可能为0.1mol/L,
故答案为:AC;
(2)A.加入催化剂能降低反应所需的活化能,b所需活化能较小,所以b是加入催化剂的反应,故A正确;
B.在密闭容器中加入1摩尔氮气3摩尔氢气,该反应是可逆反应,反应物不能完全转化,则充分反应放出的热量小于92kJ,故B正确;
C.由图可知,该反应时放热反应,断开1摩尔氮氮三键与3摩尔氢氢键吸收的能量和小于形成3摩尔氮氢键所放出的能量,故C错误;
D.该反应时放热反应,反应物的总能量高于生成物的能量,故D错误;
故选AB;
(3)①由于化学键的断裂要吸收能量,故活化状态B的能量高于初始状态A的能量,而此反应为放热反应,故初始状态A的能量高于末态C的能量,故C的能量最低,
故答案为:C;
②c0前氨的浓度增加,导致反应速率加快,c0后由于氨分子浓度太大阻碍氮气和氢气的解吸,故反应速率减慢,
故答案为:氨的浓度增加,催化剂表面吸附的氨分子增多,速率增大;达到一定浓度后,氨分子浓度太大阻碍N2和H2的解吸;
(4)阴极上氨气或铵根离子得电子发生还原反应,电极反应为2NH3+2e-=H2+2NH2- 或2NH4++2e-=H2↑+2NH3,故答案为:2NH3+2e-=H2+2NH2- 或2NH4++2e-=H2↑+2NH3.
点评 本题考查化学平衡的计算,为高频考点,把握平衡移动影响因素、反应中能量变化、电极反应、速率计算等为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.

 金钥匙试卷系列答案
金钥匙试卷系列答案| A. | 氧化铝与盐酸反应:Al2O3+6H+═2Al3++3H2O | |
| B. | 氢氧化铝与NaOH溶液反应:Al(OH)3+OH-═AlO2-+2H2O | |
| C. | 向AlCl3溶液中滴加氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | 向AlCl3溶液中加入过量NaOH溶液:Al3++4OH-═AlO2-+2H2O |
①混合气体的密度 ②混合气体的压强 ③混合气体的总物质的量 ④B的物质的量浓度.
| A. | ①④ | B. | 仅②③ | C. | ②③④ | D. | 仅④ |
| A. | 该元素为Mn元素 | B. | 该元素最高化合价为+7 | ||
| C. | 该元素属于d区元素 | D. | 该元素原子最外层共有7个电子 |
(1)工业上一般采用CO和H2反应合成可再生能源甲醇.反应如下:CO(g)+2H2(g)?CH3OH(g)△H=-90.1KJ•mol-1在250℃下,将一定量的CO和H2投入10L的密闭容器中,各物质的物质的量浓度(mol•L-1)变化如表所示:(前6min没有改变条件)
| 2min | 4min | 6nin | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.20 | … |
| CH2OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
②250℃时该反应的平衡常数K的计算式为:$\frac{0.04}{0.06×0.1{2}^{2}}$ (不必化简).
③若6min~8min只改变了某一条件,所改变的具体条件是加1 mol氢气.
④第8min时,该反应是不是达到平衡状态不是.(填“是”或“不是”)
(2)某硝酸厂处理尾气中的NO的方法是用H2将NO还原为N2.已知:

H2还原NO生成氮气和水蒸气的热化学方程式是2NO(g)+2H2(g)═N2(g)+2H2O(g)△H=-665 kJ•mol-1.
| A. | N2的电子式: | B. | S2-的结构示意图: | ||
| C. | HF的电子式: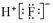 | D. | 肼(N2H4)的结构简式:H2N-NH2 |

 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用图表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用图表示:

 .
.