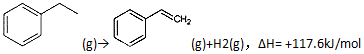题目内容
2.有机物A由C、H、O三种元素组成.现取30gA与44.8LO2(标准状况)在密闭容器中燃烧,生成CO2、CO和H2O(g).反应后将生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重36g,碱石灰增重44g.求(1)确定该有机物的分子式.
(2)写出该有机物可能的结构简式.
分析 (1)浓硫酸增重36g为水的质量,根据n=$\frac{m}{M}$计算水的物质的量,根据H原子守恒计算n(H);
碱石灰增重44g为二氧化碳的质量,n=$\frac{m}{M}$计算二氧化碳,根据n=$\frac{V}{{V}_{m}}$计算氧气的物质的量,根据m=nM计算氧气的质量,根据质量守恒计算CO的质量,n=$\frac{m}{M}$计算CO的物质的量,再根据C原子守恒计算n(C);根据氧原子守恒30gA中氧原子的质量然后可确定该物质的最简式及分子式;
(2)有机物含C、H、O元素,为醇或醚.
解答 解:(1)浓硫酸增重36g为水的质量,n(H2O)=$\frac{36g}{18g/mol}$=2mol,根据H原子守恒可知n(H)=2n(H2O)=4mol,
碱石灰增重44g为二氧化碳的质量,n(CO2)=$\frac{44g}{44g/mol}$=1mol,
标况下44.8L氧气的物质的量为:$\frac{44.8L}{22.4L/mol}$=2mol,氧气的质量为:m(O)=2mol×32g/mol=64g,
故CO的质量=30g+64g-36g-44g=14g,故 n(CO)=$\frac{14g}{28g/mol}$=0.5mol,
根据C原子守恒可知n(C)=n(CO2)+n(CO)=1mol+0.5mol=1.5mol,
由O原子守恒可知,30gA中n(O)=2n(CO2)+n(CO)+n(H2O)-2n(O2)=2×1 mol+0.5 mol+2 mol-2×2 mol=0.5mol,
根据计算可知30gA中,n(H)=4mol,n(C)=1.5mol,
则:n(C):n(H):n(O)=3:8:1,故A的最简式为C3H8O,由H原子与碳原子数目可知,H原子已经饱和C原子四价结构,故其最简式即为分子式,A的分子式为C3H8O,
答:该有机物的分子式为C3H8O;
(2)有机物的分子式为C3H8O,为醇或醚,可能结构简式为:CH3CH2CH2OH、CH3CHOHCH3、CH3OCH2CH3,
答:有机物A可能的结构简式为CH3CH2CH2OH、CH3CHOHCH3、CH3OCH2CH3.
点评 本题考查有机物分子式计算的确定,为高频考点,把握燃烧规律、原子守恒、质量守恒为解答的关键,侧重分析与应用能力的考查,注意守恒法的应用,题目难度不大.

| A. | 乙醛和丙烯醛( )不是同系物,但它们与H2充分反应后的产物是同系物 )不是同系物,但它们与H2充分反应后的产物是同系物 | |
| B. | 一分子β-月桂烯( )与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有3种 )与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有3种 | |
| C. | 用甘氨酸( )和丙氨酸( )和丙氨酸( )缩合最多可形成4种二肽 )缩合最多可形成4种二肽 | |
| D. |  和 和  都既能与NaOH溶液反应,能与溴水反应,但与两种试剂反应的原因都不完全相同 都既能与NaOH溶液反应,能与溴水反应,但与两种试剂反应的原因都不完全相同 |
| A. | HBr、CO2、NH3 | B. | Na2O、Na2O2、Na2S | C. | NaCl、HCl、H2O | D. | NaOH、CaCl2 |
| A. | SO2、SiO2、P2O5均为酸性氧化物 | |
| B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | |
| C. | 酒精、冰醋酸、草酸钾均为电解质 | |
| D. | NH4SCN、SiO2、NH3•H2O均为共价化合物 |
| A. | VIIA族元素 | B. | VIA族元素 | C. | 第三周期元素 | D. | IA族元素 |
| A. | 都是非金属氧化物 | |
| B. | 都是酸性氧化物,都能与强碱溶液反应 | |
| C. | 都能溶于水且与水反应生成相应的酸 | |
| D. | SiO2可用于制光导纤维,干冰可用于人工降雨 |
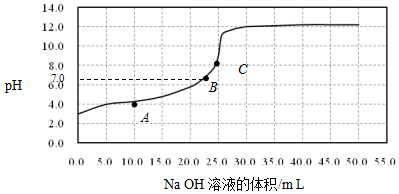
| A. | 在A点:c(HX)>c(Na+)>c(X-) | |
| B. | 在B点,溶液中c(H+)=c(OH-) | |
| C. | C点溶液中存在的主要平衡是X-+H2O?HX+OH- | |
| D. | 0.05mol/L NaX溶液的pH≈9 |
| A. | 1 mol/L CaCl2溶液中含有Cl-的数目为NA | |
| B. | 标准状况下,2.24L HF所含分子数一定为0.1NA | |
| C. | 6.4g S6与S8的混合物中所含S原子数一定为0.2NA | |
| D. | 标准状况下,2.24L 氧元素的单质所含原子数一定为0.2NA |