题目内容
12.下列与有机物结构、性质相关的叙述错误的是( )| A. | 乙醛和丙烯醛( )不是同系物,但它们与H2充分反应后的产物是同系物 )不是同系物,但它们与H2充分反应后的产物是同系物 | |
| B. | 一分子β-月桂烯(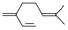 )与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有3种 )与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有3种 | |
| C. | 用甘氨酸(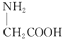 )和丙氨酸( )和丙氨酸(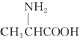 )缩合最多可形成4种二肽 )缩合最多可形成4种二肽 | |
| D. | 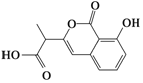 和 和 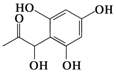 都既能与NaOH溶液反应,能与溴水反应,但与两种试剂反应的原因都不完全相同 都既能与NaOH溶液反应,能与溴水反应,但与两种试剂反应的原因都不完全相同 |
分析 A.乙醛和丙烯醛结构不相同,加成产物均为饱和一元醇;
B.与两分子溴发生加成反应,可在任意2个双键上加成;
C.氨基酸形成肽键原理为羧基提供-OH,氨基提供-H,两个氨基酸分子脱去一个水分子脱水结合形成二肽,既要考虑不同氨基酸分子间生成二肽,又要考虑同种氨基酸分子间形成二肽;
D.含-COOH、-COOC-、酚-OH均与NaOH反应,含碳碳双键、酚-OH的邻对位与溴水反应.
解答 解:A.乙醛和丙烯醛结构不相同,加成产物均为饱和一元醇,则与H2充分反应后的产物是同系物,故A正确;
B.因分子存在三种不同的碳碳双键,如图所示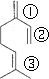 ,1分子物质与2分子Br2加成时,可以在①②的位置上发生加成,也可以在①③位置上发生加成或在②③位置上发生加成,还可以1分子Br2在①②发生1,4加成反应,另1分子Br2在③上加成,故所得产物共有四种,氨基酸生成二肽,就是两个氨基酸分子脱去一个水分子.当同种氨基酸脱水,生成2种二肽;当是异种氨基酸脱水:可以是甘氨酸脱去羟基,丙氨酸脱氢;也可以丙氨酸脱羟基,甘氨酸脱去氢,生成2种二肽,共4种,故B错误;
,1分子物质与2分子Br2加成时,可以在①②的位置上发生加成,也可以在①③位置上发生加成或在②③位置上发生加成,还可以1分子Br2在①②发生1,4加成反应,另1分子Br2在③上加成,故所得产物共有四种,氨基酸生成二肽,就是两个氨基酸分子脱去一个水分子.当同种氨基酸脱水,生成2种二肽;当是异种氨基酸脱水:可以是甘氨酸脱去羟基,丙氨酸脱氢;也可以丙氨酸脱羟基,甘氨酸脱去氢,生成2种二肽,共4种,故B错误;
C.氨基酸生成二肽,就是两个氨基酸分子脱去一个水分子.当同种氨基酸脱水,生成2种二肽;当是异种氨基酸脱水:可以是甘氨酸脱去羟基,丙氨酸脱氢;也可以丙氨酸脱羟基,甘氨酸脱去氢,生成2种二肽,共4种,故C正确;
D.前者含-COOH、-COOC-、酚-OH均与NaOH反应,后者含酚-OH与NaOH反应,前者含碳碳双键、酚-OH的邻对位与溴水反应,后者只有酚-OH的邻对位与溴水反应,与两种试剂反应的原因都不完全相同,故D正确;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意烯烃、酚、酯、羧酸的性质,题目难度不大.

| 事 实 | 结 论 | |
| A | HClO与H2SO3反应生成H2SO4和HCl | 非金属性:Cl>S |
| B | N2比白磷稳定得多 | 非金属性:N<P |
| C | 在约800℃时,金属钠可从熔融的KCl中置换出K | 金属性:Na>K |
| D | 工业上电解Na3AlF6和Al2O3的熔融混合物得到Al | 金属活动性:Na>Al |
| A. | A | B. | B | C. | C | D. | D |
| A. | 1.0 L 1.0 mol•L-1 的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 25℃时,10L pH=13的Ba(OH)2溶液中含有的OH-数为2NA | |
| C. | 常温常压下,11g D218O中所含中子数为6NA | |
| D. | 某无水乙醇与足量金属钠反应生成5.6L H2,则该乙醇分子中共价键总数为4NA |
 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.实验一:甲同学利用Al、Fe、Mg和2mol/L的稀硫酸,设计实验方案研究影响反应速率的因素.
研究的实验报告如表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
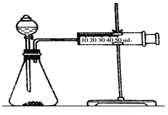
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置同温下进行定量实验,用大小形状相同的Fe分别和0.5mol/L及2mol/L的足量稀H2SO4反应,通过测定和比较同时间内产生氢气的体积可以说明浓度对化学反应速率的影响.
实验二:同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难.现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热.已知:
P4(s,白磷)+5O2(g)═P4O10(s)△H1=-2983.2kJ•mol-1①
P(s,红磷)+$\frac{5}{4}$O2(g)═$\frac{1}{4}$P4O10(s)△H2=-738.5kJ•mol-1②
则白磷转化为红磷的热化学方程式为P4(s,白磷)═4P(s,红磷)△H=-29.2 kJ•mol-1相同状况下,能量状态较低的是红磷;白磷的稳定性比红磷低(填“高”或“低”).)
| A. | 在坩埚中放入NaCl溶液,加热、蒸发得到NaCl晶体 | |
| B. | 用10 mL的量筒量取4.8 mL的盐酸 | |
| C. | 用托盘天平称取25.20 g NaCl | |
| D. | 用1000 mL容量瓶配制450 mL 0.1 mol•L-1的盐酸 |