题目内容
17.某短周期元素原子的最外电子层只有2个电子,该元素可能是( )| A. | VIIA族元素 | B. | VIA族元素 | C. | 第三周期元素 | D. | IA族元素 |
分析 短周期元素原子的最外电子层只有2个电子,可能为第ⅡA的Be、Mg,也可能为零族元素He,以此来解答.
解答 解:A.ⅦA族元素的最外层电子数为7,故A不选;
B.VIA族元素元素的最外层电子数为6,故B不选;
C.若为镁,位于第三周期,故C选;
D.ⅠA族元素的最外层电子数为1,故D不选;
故选C.
点评 本题考查元素周期表的结构及应用,为高频考点,把握最外层电子数为2及短周期为解答的关键,注意常见元素的位置及可能元素分析,题目难度不大.

练习册系列答案
相关题目
8.既能表示宏观含义,又能表示微观含义的符号是( )
| A. | 2N | B. | Fe | C. | 2H2O | D. | 2SO2 |
5.将12g铁片放入150ml的CuSO4溶液中,当溶液中的Cu2+全部被还原时,铁片质量增加0.3g,则原CuSO4溶液的物质的量浓度是( )
| A. | 0.125mol/L | B. | 0.175 mol/L | C. | 0.25 mol/L | D. | 0.50 mol/L |
9.某有机物结构简式如图 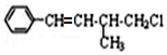 下列叙述不正确的是( )
下列叙述不正确的是( )
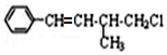 下列叙述不正确的是( )
下列叙述不正确的是( )| A. | 1mol 该有机物在加热和催化剂作用下,最多能和4 mol H2反应 | |
| B. | 该有机物分子式为C11H13Cl | |
| C. | 该有机物能通过加成、消去、水解三步反应生成: | |
| D. | 该有机物遇硝酸银溶液不能产生白色沉淀 |
6.甲.乙两同学分别对含+4价硫元素的物质性质进行了探究.
(1)甲用如图装置进行实验(气密性已检验,加热和夹持装置已略去).实验进行一段时间后,C、D中都出现明显的白色沉淀,经检验均为BaSO4.
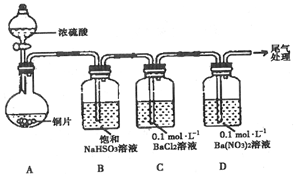
①A中反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
②为探究SO2在D中所发生的反应,甲进一步实验发现,出现白色沉淀的过程中,D溶液中NO3浓度几乎不变.甲据此得出结论:C、D中出现白色沉淀的主要原因是在酸性条件下,+4价硫被A(填序号)氧化成SO42-.
A.O2 B.Ba2+ C.NO3-
(2)乙用如下实验对含+4价硫元素的物质性质继续进行探究.(均在敞口容器中)
①用离子方程式解释实验1中产生现象的原因2H++SO32-═SO2+H2O,2SO2+O2+2Ba2++2H2O═2BaSO4↓+4H+或2H2SO3+O2+2Ba2+═2BaSO4↓+4H+.
②由实验1、2、3对比,可以得到推论:含+4价硫元素物质可被O2和浓HNO3氧化.
③乙通过查阅资料发现:Na+对实验1和2中出现浑.浊的时间无影响,于是进一步探究Cl-和NO3-对其的影响:
i.实验2和4对比,乙获得推论:Cl-的存在可以加快溶液中+4价硫元素的氧化;
ii.实验1和4对比,乙获得推论:NO3-的存在可以减慢溶液中+4价硫元素的氧化.
④通过以上实验,可以推测B装置最有可能的作用是吸收+6价硫的化合物.
(1)甲用如图装置进行实验(气密性已检验,加热和夹持装置已略去).实验进行一段时间后,C、D中都出现明显的白色沉淀,经检验均为BaSO4.

①A中反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
②为探究SO2在D中所发生的反应,甲进一步实验发现,出现白色沉淀的过程中,D溶液中NO3浓度几乎不变.甲据此得出结论:C、D中出现白色沉淀的主要原因是在酸性条件下,+4价硫被A(填序号)氧化成SO42-.
A.O2 B.Ba2+ C.NO3-
(2)乙用如下实验对含+4价硫元素的物质性质继续进行探究.(均在敞口容器中)
| 序号 | 实验操作 | 实验现象 |
| 1 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 2mol•L-1 盐酸,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,4min后,溶液变浑浊 |
| 2 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 2mol•L-1 HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,2h后,溶液变浑浊 |
| 3 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 浓HNO3,再滴入4滴BaCl2溶液 | 产生红棕色气体;滴入BaCl2溶液后,溶液立即产生大量白色沉淀 |
②由实验1、2、3对比,可以得到推论:含+4价硫元素物质可被O2和浓HNO3氧化.
③乙通过查阅资料发现:Na+对实验1和2中出现浑.浊的时间无影响,于是进一步探究Cl-和NO3-对其的影响:
| 序号 | 实验操作 | 实验现象 |
| 4 | 取0.3g纯净Na2SO3和1.17gNaCl固体混合物,向其中加入10mL 2mol•L-1 HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,20min后,溶液变浑浊 |
ii.实验1和4对比,乙获得推论:NO3-的存在可以减慢溶液中+4价硫元素的氧化.
④通过以上实验,可以推测B装置最有可能的作用是吸收+6价硫的化合物.
7.下列叙述错误的是( )
| A. | 淀粉、油脂、蛋白质在一定条件下都可以发生水解反应 | |
| B. | 溴苯分子中苯环上的一个氢原子被-C4H9原子团取代形成的同分异构体共有12种 | |
| C. | 等物质的量的乙烯和乙醇在氧气中充分燃烧后耗氧量相同 | |
| D. | 甲烷中混有乙烯可以使用溴的四氯化碳溶液或酸性KMnO4溶液除去 |