题目内容
11.化工工业中常用乙苯脱氢的方法制备苯乙烯.已知某温度下:反应①:CO2(g)+H2(g)→CO(g)+H2O(g),△H=+41.2kJ/mol
反应②:
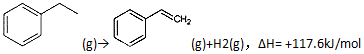
②的化学反应平衡常数分别为K1、K2.
(1)请写出二氧化碳氧化乙苯制备苯乙烯的热化学反应方程式.该反应的化学平衡常数K=K1•K2(用K1、K2表示).
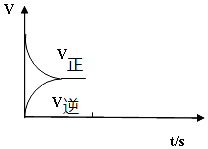
(2)温恒容条件下,反应①达到平衡后;t1时刻通入少量CO2;请在下图中画出t1之后的正逆反应曲线,并作出标注.
分析 (1)根据盖斯定律,结合已知方程式计算反应热,然后写热化学方程式;方程式相加时,总平衡常数等于分方程的平衡常数之积;
(2)恒温恒容条件下,反应①达到平衡后;t1时刻通入少量CO2,则正反应速率瞬间增大,逆反应速率逐渐增大.
解答 解:(1)已知反应①:CO2(g)+H2(g)→CO(g)+H2O(g),△H=+41.2kJ/mol
反应②: (g)→
(g)→ (g)+H2(g)△H=+117.6kJ/mol
(g)+H2(g)△H=+117.6kJ/mol
根据盖斯定律:①+②,得CO2(g)+ +CO(g)+H2O(g)△H=+41.2+117.6=+158.8kJ/mol,
+CO(g)+H2O(g)△H=+41.2+117.6=+158.8kJ/mol,
反应①与②相加得总方程,则总方程的平衡常数等于分方程的平衡常数之积,即K=K1•K2,
故答案为:CO2(g)+ +CO(g)+H2O(g)△H=+158.8 kJ/mol;K1•K2;
+CO(g)+H2O(g)△H=+158.8 kJ/mol;K1•K2;
(2)恒温恒容条件下,反应①达到平衡后;t1时刻通入少量CO2,则正反应速率瞬间增大,逆反应速率逐渐增大,其t1之后的正逆反应曲线为: ,
,
故答案为: .
.
点评 本题考查化学平衡及其影响、盖斯定律的应用,题目难度中等,明确盖斯定律的内容为解答关键,注意掌握化学平衡及其影响,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19. 甲醇是重要的化学工业基础原料和清洁液体燃料,工业上常利用CO来制备甲醇.
甲醇是重要的化学工业基础原料和清洁液体燃料,工业上常利用CO来制备甲醇.
(1)已知:
①CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H1=a kJ•mol-1
②H2(g)+CO2(g)?H2O(l)+CO(g)△H2=b kJ•mol-1
③CO燃烧热△H3=c kJ/mol
求CO(g)+2H2(g)?CH3OH(g)△H=(2b-a+2c)KJ/mol
(2)在不同的密闭容器中按如下投料方式进行反应:
反应进行2min后,容器2中反应达到平衡状态.
①计算800℃时,从反应开始至达到化学平衡,以H2的浓度变化表示的化学反应速率是0.06mol/(L•min),此温度下的平衡常数K=17.36(列出表达式并计算结果,结果保留两位小数)
②下列说法正确的是D
A.X大于0.16
B.当v(CO)正=2v(H2)逆时,反应达到平衡状态
C.平衡后,向容器1中通入0.2mol的CO和0.2mol的H2,再次达到平衡时CO转化率增大
D.K1>K2=K3
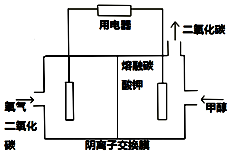
(3)甲醇燃料电池由于其结构简单、能量转化率高、对环境无污染,而越来越受到关注,如图是一种甲醇燃料电池的工作原理
①写出该燃料电池负极电极反应方程式:CH3OH-6e-+3CO32-=4CO2↑+2H2O
②当电路中有0.6mol电子通过时,需要在正极通入的标况下氧气的体积为3.36L,将生成的气体全部通入2L 0.3mol/L的氢氧化钠溶液中,此时溶液中各离子浓度由大到小顺序为c(Na+)>c(OH-)>c(CO32-)>c(HCO3-)>c(H+).
 甲醇是重要的化学工业基础原料和清洁液体燃料,工业上常利用CO来制备甲醇.
甲醇是重要的化学工业基础原料和清洁液体燃料,工业上常利用CO来制备甲醇.(1)已知:
①CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H1=a kJ•mol-1
②H2(g)+CO2(g)?H2O(l)+CO(g)△H2=b kJ•mol-1
③CO燃烧热△H3=c kJ/mol
求CO(g)+2H2(g)?CH3OH(g)△H=(2b-a+2c)KJ/mol
(2)在不同的密闭容器中按如下投料方式进行反应:
| 容器编号 | 容器体积/L | 温度/K | CO物质的量/mol | H2物质的量/mol | CH3OH物质的量/mol | 平衡时CO浓度/mol•L-1 | 平衡常数K |
| 1 | 1.0 | 500 | 0.2 | 0.2 | 0 | 0.12 | K1 |
| 2 | 1.0 | 800 | 0.1 | 0 | 0.1 | 0.16 | K2 |
| 3 | 2.0 | 800 | 0.2 | 0.2 | 0 | X | K3 |
①计算800℃时,从反应开始至达到化学平衡,以H2的浓度变化表示的化学反应速率是0.06mol/(L•min),此温度下的平衡常数K=17.36(列出表达式并计算结果,结果保留两位小数)
②下列说法正确的是D
A.X大于0.16
B.当v(CO)正=2v(H2)逆时,反应达到平衡状态
C.平衡后,向容器1中通入0.2mol的CO和0.2mol的H2,再次达到平衡时CO转化率增大
D.K1>K2=K3
(3)甲醇燃料电池由于其结构简单、能量转化率高、对环境无污染,而越来越受到关注,如图是一种甲醇燃料电池的工作原理
①写出该燃料电池负极电极反应方程式:CH3OH-6e-+3CO32-=4CO2↑+2H2O
②当电路中有0.6mol电子通过时,需要在正极通入的标况下氧气的体积为3.36L,将生成的气体全部通入2L 0.3mol/L的氢氧化钠溶液中,此时溶液中各离子浓度由大到小顺序为c(Na+)>c(OH-)>c(CO32-)>c(HCO3-)>c(H+).
6.甲.乙两同学分别对含+4价硫元素的物质性质进行了探究.
(1)甲用如图装置进行实验(气密性已检验,加热和夹持装置已略去).实验进行一段时间后,C、D中都出现明显的白色沉淀,经检验均为BaSO4.
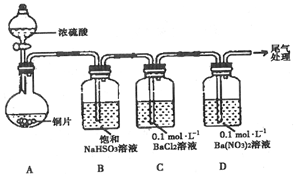
①A中反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
②为探究SO2在D中所发生的反应,甲进一步实验发现,出现白色沉淀的过程中,D溶液中NO3浓度几乎不变.甲据此得出结论:C、D中出现白色沉淀的主要原因是在酸性条件下,+4价硫被A(填序号)氧化成SO42-.
A.O2 B.Ba2+ C.NO3-
(2)乙用如下实验对含+4价硫元素的物质性质继续进行探究.(均在敞口容器中)
①用离子方程式解释实验1中产生现象的原因2H++SO32-═SO2+H2O,2SO2+O2+2Ba2++2H2O═2BaSO4↓+4H+或2H2SO3+O2+2Ba2+═2BaSO4↓+4H+.
②由实验1、2、3对比,可以得到推论:含+4价硫元素物质可被O2和浓HNO3氧化.
③乙通过查阅资料发现:Na+对实验1和2中出现浑.浊的时间无影响,于是进一步探究Cl-和NO3-对其的影响:
i.实验2和4对比,乙获得推论:Cl-的存在可以加快溶液中+4价硫元素的氧化;
ii.实验1和4对比,乙获得推论:NO3-的存在可以减慢溶液中+4价硫元素的氧化.
④通过以上实验,可以推测B装置最有可能的作用是吸收+6价硫的化合物.
(1)甲用如图装置进行实验(气密性已检验,加热和夹持装置已略去).实验进行一段时间后,C、D中都出现明显的白色沉淀,经检验均为BaSO4.

①A中反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
②为探究SO2在D中所发生的反应,甲进一步实验发现,出现白色沉淀的过程中,D溶液中NO3浓度几乎不变.甲据此得出结论:C、D中出现白色沉淀的主要原因是在酸性条件下,+4价硫被A(填序号)氧化成SO42-.
A.O2 B.Ba2+ C.NO3-
(2)乙用如下实验对含+4价硫元素的物质性质继续进行探究.(均在敞口容器中)
| 序号 | 实验操作 | 实验现象 |
| 1 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 2mol•L-1 盐酸,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,4min后,溶液变浑浊 |
| 2 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 2mol•L-1 HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,2h后,溶液变浑浊 |
| 3 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 浓HNO3,再滴入4滴BaCl2溶液 | 产生红棕色气体;滴入BaCl2溶液后,溶液立即产生大量白色沉淀 |
②由实验1、2、3对比,可以得到推论:含+4价硫元素物质可被O2和浓HNO3氧化.
③乙通过查阅资料发现:Na+对实验1和2中出现浑.浊的时间无影响,于是进一步探究Cl-和NO3-对其的影响:
| 序号 | 实验操作 | 实验现象 |
| 4 | 取0.3g纯净Na2SO3和1.17gNaCl固体混合物,向其中加入10mL 2mol•L-1 HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,20min后,溶液变浑浊 |
ii.实验1和4对比,乙获得推论:NO3-的存在可以减慢溶液中+4价硫元素的氧化.
④通过以上实验,可以推测B装置最有可能的作用是吸收+6价硫的化合物.
16.化学与生活密切相关,下列说法不正确的是( )
| A. | 天然气、酒精分别属于化石能源、可再生能源 | |
| B. | 金属在潮湿空气中生锈,主要是发生析氢腐蚀 | |
| C. | NaClO具有强氧化性,可作织物漂白剂 | |
| D. | 高纯硅广泛应用于太阳能电池和半导体材料的制造 |
3.已知:氟硼酸(HBF4)是强酸,Pb(BF4)2是可溶于水的强电解质,某二次电池能在低温下工作,其工作原理是Pb+PbO2+4HBF4$?_{充电}^{放电}$2Pb(BF4)2+2H2O,下列说法正确的是( )
| A. | 放电时,正极区的pH增大 | |
| B. | 放电时,负极的电极反应式为PbO4+4H++2e-═Pb2++2H2O | |
| C. | 充电时,铅电极与电源的正极相连 | |
| D. | 充电时,当阴极生成20.7g Pb时溶液中有0.2mol电子通过 |
20.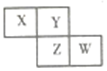 如图是从元素周期表中截取的一部分,已知X、Y、Z、W四种短周期主族元素,下列说法中正确的是( )
如图是从元素周期表中截取的一部分,已知X、Y、Z、W四种短周期主族元素,下列说法中正确的是( )
 如图是从元素周期表中截取的一部分,已知X、Y、Z、W四种短周期主族元素,下列说法中正确的是( )
如图是从元素周期表中截取的一部分,已知X、Y、Z、W四种短周期主族元素,下列说法中正确的是( )| A. | W的原子序数不可能是X的原子序数的3倍 | |
| B. | Z元素可能为金属 | |
| C. | 四种元素的原子有可能均能与氢原子形成18电子分子 | |
| D. | W的气态氢化物的稳定性一定比Y的强 |
16.下列操作过程中使溶液导电性变化较大的是 ( )
| A. | 100ml 0.1mol/L的氯水中通入0.01molSO2气体 | |
| B. | 100ml 0.5mol/L的NaOH中通入0.005mol氯气 | |
| C. | 100ml 0.5mol/L的CuSO4溶液中加入4g NaOH固体 | |
| D. | 100ml自来水中加入0.01mol蔗糖溶解 |