题目内容
10.下列物质分类正确的是( )| A. | SO2、SiO2、P2O5均为酸性氧化物 | |
| B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | |
| C. | 酒精、冰醋酸、草酸钾均为电解质 | |
| D. | NH4SCN、SiO2、NH3•H2O均为共价化合物 |
分析 A、能和碱反应生成盐和水的氧化物为酸性氧化物;
B、分散质粒子直径介于1-100nm之间的分散系为胶体;
C、在水溶液中或熔融状态下能导电的化合物为电解质;
D、全部由国共价键形成的化合物为共价化合物.
解答 解:A、能和碱反应生成盐和水的氧化物为酸性氧化物,SO2、SiO2、P2O5均能和碱反应生成盐和水,故为酸性氧化物,故A正确;
B、分散质粒子直径介于1-100nm之间的分散系为胶体,稀豆浆和硅酸是胶体,氯化铁溶液是溶液而非胶体,故B错误;
C、在水溶液中或熔融状态下能导电的化合物为电解质,酒精在水溶液中和熔融状态下均不能导电,故为非电解质,故C错误;
D、全部由国共价键形成的化合物为共价化合物,而NH4SCN由铵根离子和SCN-构成,故不是共价化合物,故D错误.
故选A.
点评 本题考查了酸性氧化物、胶体、电解质非电解质和共价化合物的辨别,难度不大,应注意的是由非金属元素形成的化合物不一定是共价化合物.

练习册系列答案
相关题目
18.下列有关化学用语的表示,正确的是( )
| A. | 甲烷的电子式: | B. | CCl4分子的比例模型: | ||
| C. | 乙烯与丁二烯的最简式相同 | D. | 2-甲基丁醇的结构简式: |
5.将12g铁片放入150ml的CuSO4溶液中,当溶液中的Cu2+全部被还原时,铁片质量增加0.3g,则原CuSO4溶液的物质的量浓度是( )
| A. | 0.125mol/L | B. | 0.175 mol/L | C. | 0.25 mol/L | D. | 0.50 mol/L |
15.醋酸的下列性质中,可以证明它是弱电解质的是( )
| A. | 1mol/L的醋酸溶液中c(H+)=0.01 mol/L | |
| B. | 醋酸能与水以任何比例互溶 | |
| C. | 10mL1mol/L醋酸恰好与10mL1mol/LNaOH溶液完全反应 | |
| D. | 醋酸溶液的导电性比盐酸的弱 |
19.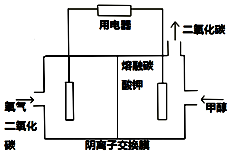 甲醇是重要的化学工业基础原料和清洁液体燃料,工业上常利用CO来制备甲醇.
甲醇是重要的化学工业基础原料和清洁液体燃料,工业上常利用CO来制备甲醇.
(1)已知:
①CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H1=a kJ•mol-1
②H2(g)+CO2(g)?H2O(l)+CO(g)△H2=b kJ•mol-1
③CO燃烧热△H3=c kJ/mol
求CO(g)+2H2(g)?CH3OH(g)△H=(2b-a+2c)KJ/mol
(2)在不同的密闭容器中按如下投料方式进行反应:
反应进行2min后,容器2中反应达到平衡状态.
①计算800℃时,从反应开始至达到化学平衡,以H2的浓度变化表示的化学反应速率是0.06mol/(L•min),此温度下的平衡常数K=17.36(列出表达式并计算结果,结果保留两位小数)
②下列说法正确的是D
A.X大于0.16
B.当v(CO)正=2v(H2)逆时,反应达到平衡状态
C.平衡后,向容器1中通入0.2mol的CO和0.2mol的H2,再次达到平衡时CO转化率增大
D.K1>K2=K3
(3)甲醇燃料电池由于其结构简单、能量转化率高、对环境无污染,而越来越受到关注,如图是一种甲醇燃料电池的工作原理
①写出该燃料电池负极电极反应方程式:CH3OH-6e-+3CO32-=4CO2↑+2H2O
②当电路中有0.6mol电子通过时,需要在正极通入的标况下氧气的体积为3.36L,将生成的气体全部通入2L 0.3mol/L的氢氧化钠溶液中,此时溶液中各离子浓度由大到小顺序为c(Na+)>c(OH-)>c(CO32-)>c(HCO3-)>c(H+).
 甲醇是重要的化学工业基础原料和清洁液体燃料,工业上常利用CO来制备甲醇.
甲醇是重要的化学工业基础原料和清洁液体燃料,工业上常利用CO来制备甲醇.(1)已知:
①CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H1=a kJ•mol-1
②H2(g)+CO2(g)?H2O(l)+CO(g)△H2=b kJ•mol-1
③CO燃烧热△H3=c kJ/mol
求CO(g)+2H2(g)?CH3OH(g)△H=(2b-a+2c)KJ/mol
(2)在不同的密闭容器中按如下投料方式进行反应:
| 容器编号 | 容器体积/L | 温度/K | CO物质的量/mol | H2物质的量/mol | CH3OH物质的量/mol | 平衡时CO浓度/mol•L-1 | 平衡常数K |
| 1 | 1.0 | 500 | 0.2 | 0.2 | 0 | 0.12 | K1 |
| 2 | 1.0 | 800 | 0.1 | 0 | 0.1 | 0.16 | K2 |
| 3 | 2.0 | 800 | 0.2 | 0.2 | 0 | X | K3 |
①计算800℃时,从反应开始至达到化学平衡,以H2的浓度变化表示的化学反应速率是0.06mol/(L•min),此温度下的平衡常数K=17.36(列出表达式并计算结果,结果保留两位小数)
②下列说法正确的是D
A.X大于0.16
B.当v(CO)正=2v(H2)逆时,反应达到平衡状态
C.平衡后,向容器1中通入0.2mol的CO和0.2mol的H2,再次达到平衡时CO转化率增大
D.K1>K2=K3
(3)甲醇燃料电池由于其结构简单、能量转化率高、对环境无污染,而越来越受到关注,如图是一种甲醇燃料电池的工作原理
①写出该燃料电池负极电极反应方程式:CH3OH-6e-+3CO32-=4CO2↑+2H2O
②当电路中有0.6mol电子通过时,需要在正极通入的标况下氧气的体积为3.36L,将生成的气体全部通入2L 0.3mol/L的氢氧化钠溶液中,此时溶液中各离子浓度由大到小顺序为c(Na+)>c(OH-)>c(CO32-)>c(HCO3-)>c(H+).
20.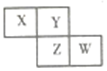 如图是从元素周期表中截取的一部分,已知X、Y、Z、W四种短周期主族元素,下列说法中正确的是( )
如图是从元素周期表中截取的一部分,已知X、Y、Z、W四种短周期主族元素,下列说法中正确的是( )
 如图是从元素周期表中截取的一部分,已知X、Y、Z、W四种短周期主族元素,下列说法中正确的是( )
如图是从元素周期表中截取的一部分,已知X、Y、Z、W四种短周期主族元素,下列说法中正确的是( )| A. | W的原子序数不可能是X的原子序数的3倍 | |
| B. | Z元素可能为金属 | |
| C. | 四种元素的原子有可能均能与氢原子形成18电子分子 | |
| D. | W的气态氢化物的稳定性一定比Y的强 |