题目内容
12.用NA表示阿伏伽德罗常数的值,下列说法中正确的是( )| A. | 1 mol/L CaCl2溶液中含有Cl-的数目为NA | |
| B. | 标准状况下,2.24L HF所含分子数一定为0.1NA | |
| C. | 6.4g S6与S8的混合物中所含S原子数一定为0.2NA | |
| D. | 标准状况下,2.24L 氧元素的单质所含原子数一定为0.2NA |
分析 A、溶液体积不明确;
B、标况下HF为液体;
C、S6与S8均由S原子构成;
D、氧元素的单质有氧气和臭氧.
解答 解:A、溶液体积不明确,故溶液中的氯离子的个数无法计算,故A错误;
B、标况下HF为液体,故不能根据气体摩尔体积来计算其物质的量,故B错误;
C、S6与S8均由S原子构成,故6.4g混合物中含有的S原子的物质的量n=$\frac{6.4g}{32g/mol}$=0.2mol,个数为0.2NA个,故C正确;
D、氧元素的单质有氧气和臭氧,故标况下2.24L氧元素的单质即0.1mol氧元素的单质中含有的原子个数可能为0.2NA个,还可能为0.3NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
3.已知:氟硼酸(HBF4)是强酸,Pb(BF4)2是可溶于水的强电解质,某二次电池能在低温下工作,其工作原理是Pb+PbO2+4HBF4$?_{充电}^{放电}$2Pb(BF4)2+2H2O,下列说法正确的是( )
| A. | 放电时,正极区的pH增大 | |
| B. | 放电时,负极的电极反应式为PbO4+4H++2e-═Pb2++2H2O | |
| C. | 充电时,铅电极与电源的正极相连 | |
| D. | 充电时,当阴极生成20.7g Pb时溶液中有0.2mol电子通过 |
20.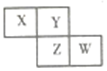 如图是从元素周期表中截取的一部分,已知X、Y、Z、W四种短周期主族元素,下列说法中正确的是( )
如图是从元素周期表中截取的一部分,已知X、Y、Z、W四种短周期主族元素,下列说法中正确的是( )
 如图是从元素周期表中截取的一部分,已知X、Y、Z、W四种短周期主族元素,下列说法中正确的是( )
如图是从元素周期表中截取的一部分,已知X、Y、Z、W四种短周期主族元素,下列说法中正确的是( )| A. | W的原子序数不可能是X的原子序数的3倍 | |
| B. | Z元素可能为金属 | |
| C. | 四种元素的原子有可能均能与氢原子形成18电子分子 | |
| D. | W的气态氢化物的稳定性一定比Y的强 |
7.下列叙述错误的是( )
| A. | 淀粉、油脂、蛋白质在一定条件下都可以发生水解反应 | |
| B. | 溴苯分子中苯环上的一个氢原子被-C4H9原子团取代形成的同分异构体共有12种 | |
| C. | 等物质的量的乙烯和乙醇在氧气中充分燃烧后耗氧量相同 | |
| D. | 甲烷中混有乙烯可以使用溴的四氯化碳溶液或酸性KMnO4溶液除去 |
17.下列晶体属于原子晶体,且晶体内只含极性键的是( )
| A. | I2 | B. | Si3N4 | C. | CO2 | D. | Si |
4.a g铜与含b g HNO3的硝酸溶液恰好完全反应,若a:b=8:21,则反应中起氧化作用的HNO3的质量是( )
| A. | b g | B. | $\frac{3b}{4}$g | C. | $\frac{b}{2}$g | D. | $\frac{b}{4}$g |
16.下列操作过程中使溶液导电性变化较大的是 ( )
| A. | 100ml 0.1mol/L的氯水中通入0.01molSO2气体 | |
| B. | 100ml 0.5mol/L的NaOH中通入0.005mol氯气 | |
| C. | 100ml 0.5mol/L的CuSO4溶液中加入4g NaOH固体 | |
| D. | 100ml自来水中加入0.01mol蔗糖溶解 |
17.化学实验中安全意识是重要的学科素养.下列说法正确的是( )
| A. | 凑近集气瓶中闻氯气的气味 | |
| B. | 圆底烧瓶可以用酒精灯直接加热 | |
| C. | 金属钠着火时,用沙子扑灭 | |
| D. | 浓盐酸沾到皮肤上,用氢氧化钠溶液冲洗 |