题目内容
12.根据下列热化学方程式,判断氢化物的稳定性顺序正确的是( )$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)=NH3(g)△H=-46.19kJ•mol-1
$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g)△H=-92.36kJ•mol-1
$\frac{1}{2}$I2(g)+$\frac{1}{2}$H2(g)=HI(g)△H=-4.74kJ•mol-1.
| A. | HCl>NH3>HI | B. | HI>HCl>NH3 | C. | HCl>HI>NH3 | D. | NH3>HI>HCl |
分析 放热反应更容易自发进行,非金属单质和氢气化合越容易,得到的气态氢化物越稳定,据此分析.
解答 解:放热反应更容易自发进行,非金属单质和氢气化合越容易,得到的气态氢化物越稳定,由于Cl2、N2和I2与氢气化合越来越难,故HCl、NH3、HI的稳定性越来越差,故稳定性为:HCl>NH3>HI,故选A.
点评 本题考查了物质的稳定性比较,应注意的是与氢气化合越容易,氢化物越稳定.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
2.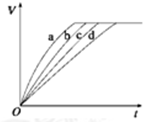 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )| 组别 | 对应曲线 | C(HCl)/mol•L-1 | 反应温度/℃ | 铁的状态 |
| 1 | a | 30 | 粉末状 | |
| 2 | b | 30 | 粉末状 | |
| 3 | c | 2.5 | 块状 | |
| 4 | d | 2.5 | 30 | 块状 |
| A. | 第4组实验的反应速率最慢 | |
| B. | 第1组实验中盐酸的浓度可能最大 | |
| C. | 第2组实验中盐酸的浓度可能等于2.5 mol•L-1 | |
| D. | 第3组实验的反应温度可能低于30℃ |
3.决定化学反应速率的根本因素是( )
| A. | 合适的催化剂 | B. | 温度和压强 | C. | 反应物的浓度 | D. | 反应物的性质 |
20.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:

下列说法中正确的是( )

下列说法中正确的是( )
| A. | 1mol N2(g)和1 mol O2(g)完全反应放出的能量为180 kJ | |
| B. | 通常情况下,N2(g)和O2(g)混合能直接生成NO | |
| C. | 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 | |
| D. | NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
7.下列物质不能通过化合反应得到的物质是( )
| A. | CuCl2 | B. | FeCl2 | C. | FeS | D. | CuS |
17.下列说法正确的是( )
| A. | 容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度 | |
| B. | 检验SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 | |
| C. | 为观察镁条在CO2中的燃烧,取一小段除去表面氧化膜的镁条用坩埚钳夹持点燃后,迅速投入底部铺有少量玻璃棉的CO2集气瓶底部 | |
| D. | 用干燥洁净玻璃棒蘸取NaClO溶液,滴到pH试纸上测pH值 |
4.我国科学家不久前成功合成了3mm长的管状定向碳纳米管,长度居世界之首,这种碳纤维具有强度高、硬度(抵抗变形能力)高、密度小(只有钢的$\frac{1}{4}$)、熔点高、化学稳定性好等特点,因而被称为“超级纤维”.对碳纤维的下列说法中不正确的是( )
| A. | 它是制造飞机的理想材料 | B. | 它是一种新的碳单质 | ||
| C. | 它的结构与石墨相似 | D. | 碳纤维复合材料不易导电 |
17.常温下用 a L pH=3的HX溶液与 b L pH=11的氢氧化钠溶液相混合,下列叙述正确的是( )
| A. | 若二者恰好中和,则一定是 a=b | B. | 若混合液显碱性,则一定是 b≥a | ||
| C. | 若混合液显中性,则一定是 a≤b | D. | 若混合液显酸性,则一定是 a>b |
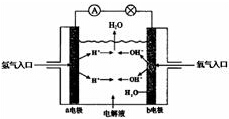 某种氢氧燃料电池的电解液为K0H溶液,该燃料电池的总反应方程式为:2H2+O2═2H2O.完成下列问题.
某种氢氧燃料电池的电解液为K0H溶液,该燃料电池的总反应方程式为:2H2+O2═2H2O.完成下列问题.