题目内容
20.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:
下列说法中正确的是( )
| A. | 1mol N2(g)和1 mol O2(g)完全反应放出的能量为180 kJ | |
| B. | 通常情况下,N2(g)和O2(g)混合能直接生成NO | |
| C. | 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 | |
| D. | NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
分析 A、分析能量变化黑球代表氧原子,依据反应焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量计算判断;
B、氮气和氧气在放电条件才能反应;
C、依据A计算的焓变判断反应能量变化,结合反应前后能量守恒分析;
D、一氧化氮不能和氢氧化钠反应.
解答 解:A.1 mol N2(g)和1 mol O2(g)完全反应,产生2mol气态NO时,反应过程中能量变化为946kJ+498kJ-2×632kJ=-180 kJ,由于题目未指明生成物的聚集状态,所以能量变化没有意义,故A错误;
B.无论是放热反应,还是吸热反应,都需要有活化过程,所以通常情况下,N2(g)和O2(g)混合不能直接生成NO,故B错误;
C.由于1 mol N2(g)和1 mol O2(g)具有的键能小于2 mol NO(g)具有的键能,所以反应物具有的总能量小于2 mol NO(g)具有的总能量,故C正确;
D.NO是一种不成盐氧化物,不能与NaOH溶液反应生成盐和水,故D错误.
故选:C.
点评 本题考查了反应能量变化的计算和判断,反应的焓变计算方法和能量守恒是解题关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.下列有关性质的比较,不能用元素周期律解释的是( )
| A. | 酸性:H2CO3>H2SiO3 | B. | 非金属性:O>S | ||
| C. | 碱性:NaOH>Al(OH)3 | D. | 热稳定性:K2CO3>KHCO3 |
11.下列金属中,其离子溶于水中不会造成水体污染的是( )
| A. | 铅 | B. | 铬 | C. | 镉 | D. | 镁 |
8.当C(s)+CO2(g)?2CO(g)△H>0达到平衡后,下列变化将使该反应逆向进行的是( )
| A. | 减小压强 | B. | 降低温度 | C. | 增大c(CO2) | D. | 升高温度 |
15.一定条件下,可逆反应X(g)+3Y(g)?2Z(g),若X、Y、Z起始浓度分别为C1、C2、C3(均不为0);平衡时,X、Y、Z的浓度分别为0.2mol•L-1,0.6mol•L-1,0.16mol•L-1,则下列判断不合理的是( )
| A. | 若反应从正方向开始,X、Y的转化率可能不相等 | |
| B. | C1:C2=1:3 | |
| C. | 平衡时,X和Z的生成速率之比为1:2 | |
| D. | C2的取值范围为0<C2<0.84 mol•L-1 |
5.目前已有包括我国在内的多个国家试制无冷却式陶瓷发动机汽车,使热效率大幅度提高.可用作制造这种发动机的耐高温材料是( )
| A. | 氮化硅陶瓷 | B. | 水泥 | C. | 光导纤维 | D. | 玻璃钢 |
12.根据下列热化学方程式,判断氢化物的稳定性顺序正确的是( )
$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)=NH3(g)△H=-46.19kJ•mol-1
$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g)△H=-92.36kJ•mol-1
$\frac{1}{2}$I2(g)+$\frac{1}{2}$H2(g)=HI(g)△H=-4.74kJ•mol-1.
$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)=NH3(g)△H=-46.19kJ•mol-1
$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g)△H=-92.36kJ•mol-1
$\frac{1}{2}$I2(g)+$\frac{1}{2}$H2(g)=HI(g)△H=-4.74kJ•mol-1.
| A. | HCl>NH3>HI | B. | HI>HCl>NH3 | C. | HCl>HI>NH3 | D. | NH3>HI>HCl |
9.已知某有机物X的结构简式如图所示,下列有关叙述不正确的是( )
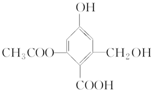

| A. | 1 mol X最多可与3 mol H2发生加成反应 | |
| B. | X在一定条件下能与FeCl3溶液发生显色反应 | |
| C. | X在一定条件下能发生消去反应和酯化反应 | |
| D. | 1 mol X分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗Na、NaOH、NaHCO3的物质的量分别为3 mol、4 mol、1 mol |
5. 如图所示,m表示溶液中生成沉淀的物质的量,n表示溶液中加入物质的量.下列反应中,能按照如图曲线进行的是( )
如图所示,m表示溶液中生成沉淀的物质的量,n表示溶液中加入物质的量.下列反应中,能按照如图曲线进行的是( )
 如图所示,m表示溶液中生成沉淀的物质的量,n表示溶液中加入物质的量.下列反应中,能按照如图曲线进行的是( )
如图所示,m表示溶液中生成沉淀的物质的量,n表示溶液中加入物质的量.下列反应中,能按照如图曲线进行的是( )| A. | 往Ca(OH)2和KOH的混合溶液中通入CO2 | |
| B. | 往AlCl3和NH4Cl的混合溶液中加NaOH溶液 | |
| C. | 往Al2(SO4)3和(NH4)2SO4的混合溶液中加Ba(OH)2溶液 | |
| D. | 往NH4Al(SO4)2溶液中加入NaOH溶液 |