题目内容
4.我国科学家不久前成功合成了3mm长的管状定向碳纳米管,长度居世界之首,这种碳纤维具有强度高、硬度(抵抗变形能力)高、密度小(只有钢的$\frac{1}{4}$)、熔点高、化学稳定性好等特点,因而被称为“超级纤维”.对碳纤维的下列说法中不正确的是( )| A. | 它是制造飞机的理想材料 | B. | 它是一种新的碳单质 | ||
| C. | 它的结构与石墨相似 | D. | 碳纤维复合材料不易导电 |
分析 根据题干所给信息中碳纤维的物理性质和化学性质分析:具有强度高、刚度(抵抗变形的能力)大、密度小(只有钢的四分之一)、熔点高;化学稳定性好,该碳纤维是一种单质,硬度高,与石墨不相似.
解答 解:A、这种碳纤维的强度高、刚度高、密度小、熔点高、化学稳定性好,是制造飞机的理想材料,故A正确;
B、碳纤维的主要组成元素是碳,是一种新的碳单质,故B正确;
C、石墨的强度小、刚度低,与碳纤维性质差别较大,所以石墨与这种碳纤维的结构不同,故C错误;
D、碳纤维主要组成元素是碳,不是化合物,故D正确;
故选C.
点评 本题主要考查物质的性质和用途,难度不大,解答时要充分理解各种物质的性质,然后再根据物质的性质方面进行分析、判断,从而确定物质的用途.

练习册系列答案
相关题目
14.已知aRO4x-+bH++cCl-═dR2++5Cl2↑+8H2O,则RO4x-中R的化合价为( )
| A. | +4 | B. | +5 | C. | +6 | D. | +7 |
15.一定条件下,可逆反应X(g)+3Y(g)?2Z(g),若X、Y、Z起始浓度分别为C1、C2、C3(均不为0);平衡时,X、Y、Z的浓度分别为0.2mol•L-1,0.6mol•L-1,0.16mol•L-1,则下列判断不合理的是( )
| A. | 若反应从正方向开始,X、Y的转化率可能不相等 | |
| B. | C1:C2=1:3 | |
| C. | 平衡时,X和Z的生成速率之比为1:2 | |
| D. | C2的取值范围为0<C2<0.84 mol•L-1 |
12.根据下列热化学方程式,判断氢化物的稳定性顺序正确的是( )
$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)=NH3(g)△H=-46.19kJ•mol-1
$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g)△H=-92.36kJ•mol-1
$\frac{1}{2}$I2(g)+$\frac{1}{2}$H2(g)=HI(g)△H=-4.74kJ•mol-1.
$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)=NH3(g)△H=-46.19kJ•mol-1
$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g)△H=-92.36kJ•mol-1
$\frac{1}{2}$I2(g)+$\frac{1}{2}$H2(g)=HI(g)△H=-4.74kJ•mol-1.
| A. | HCl>NH3>HI | B. | HI>HCl>NH3 | C. | HCl>HI>NH3 | D. | NH3>HI>HCl |
19.ABS合成树脂的结构可表示为 ,则合成该树脂的单体的种类和反应所属类型,正确的是( )
,则合成该树脂的单体的种类和反应所属类型,正确的是( )
 ,则合成该树脂的单体的种类和反应所属类型,正确的是( )
,则合成该树脂的单体的种类和反应所属类型,正确的是( )| A. | 1种,加聚反应 | B. | 2种,缩聚反应 | C. | 3种,加聚反应 | D. | 3种,缩聚反应 |
9.已知某有机物X的结构简式如图所示,下列有关叙述不正确的是( )


| A. | 1 mol X最多可与3 mol H2发生加成反应 | |
| B. | X在一定条件下能与FeCl3溶液发生显色反应 | |
| C. | X在一定条件下能发生消去反应和酯化反应 | |
| D. | 1 mol X分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗Na、NaOH、NaHCO3的物质的量分别为3 mol、4 mol、1 mol |
16.以下判断中不正确的是( )
| A. | 微粒半径:Fe2+>Fe3+ | |
| B. | 酸性:HClO4>H2SO4>H2SeO4 | |
| C. | 反应活泼性:O>03>02 | |
| D. | 物质的量浓度:pH相等时,CH3C00H>HCl0. |
8.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 1molCH5+中含有的电子数目为11NA | |
| B. | 0.1mol/L AlCl3溶液中含有的Al3+数目一定小于0.1NA | |
| C. | 78gNa2O2和Na2S的混合物中含有的阴离子数目一定是NA | |
| D. | 常温下,1L PH=1的H2SO4溶液中,由水电离出的H+数目为0.1NA |
9.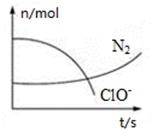 某反应体系中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种微粒,反应过程中测得ClO-和N2的物质的量随时间的变化如图所示.有关判断正确的是( )
某反应体系中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种微粒,反应过程中测得ClO-和N2的物质的量随时间的变化如图所示.有关判断正确的是( )
 某反应体系中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种微粒,反应过程中测得ClO-和N2的物质的量随时间的变化如图所示.有关判断正确的是( )
某反应体系中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种微粒,反应过程中测得ClO-和N2的物质的量随时间的变化如图所示.有关判断正确的是( )| A. | 氧化剂是ClO-,还原产物是HCO3- | |
| B. | 反应体系中反应物与生成物各有三种微粒 | |
| C. | 氧化剂与还原剂的物质的量之比为5:2 | |
| D. | 生成2.24L N2(标准状况)时转移电子0.5 mol |