题目内容
1.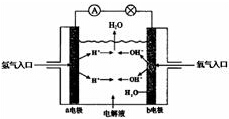 某种氢氧燃料电池的电解液为K0H溶液,该燃料电池的总反应方程式为:2H2+O2═2H2O.完成下列问题.
某种氢氧燃料电池的电解液为K0H溶液,该燃料电池的总反应方程式为:2H2+O2═2H2O.完成下列问题.(1)该燃料电池的a电极为负极,其电极反应式H2-2e-+2OH-=2H2O.
(2)该电池工作一段时间后,正极区溶液的碱性增大,电解液中KOH的物质的量不变,物质的量浓度减小(填“增大”“减小”或“不变”).
(3)消耗22.4LH2(标准状况)时,有2mol电子转移.
分析 KOH溶液为电解液的氢氧燃料电池中,通入氢气的一极为电池的负极,发生氧化反应,电极反应式为H2-2e-+2OH-=2H2O,通入氧气的一极为电池的正极,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,反应的总方程式为2H2+O2=2H2O,结合电极反应解答该题.
解答 解:(1)H失去电子,氢离子向正极移动,则该燃料电池的a电极为负极,其电极反应式为H2-2e-+2OH-=2H2O,故答案为:a;H2-2e-+2OH-=2H2O;
(2)正极反应式为O2+2H2O+4e-=4OH-,则该电池工作一段时间后,正极区溶液的碱性增强,由总反应为2H2+O2=2H2O,电解液中KOH的物质的量不变,则浓度减小,
故答案为:增大;不变;减小;
(3)消耗22.4LH2(标准状况)时,转移电子为$\frac{22.4L}{22.4L/mol}$×2×(1-0)=2mol,故答案为:2.
点评 本题考查原电池及电极反应,为高频考点,把握发生的电极反应及物质的量的相关计算为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
11.下列金属中,其离子溶于水中不会造成水体污染的是( )
| A. | 铅 | B. | 铬 | C. | 镉 | D. | 镁 |
12.根据下列热化学方程式,判断氢化物的稳定性顺序正确的是( )
$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)=NH3(g)△H=-46.19kJ•mol-1
$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g)△H=-92.36kJ•mol-1
$\frac{1}{2}$I2(g)+$\frac{1}{2}$H2(g)=HI(g)△H=-4.74kJ•mol-1.
$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)=NH3(g)△H=-46.19kJ•mol-1
$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g)△H=-92.36kJ•mol-1
$\frac{1}{2}$I2(g)+$\frac{1}{2}$H2(g)=HI(g)△H=-4.74kJ•mol-1.
| A. | HCl>NH3>HI | B. | HI>HCl>NH3 | C. | HCl>HI>NH3 | D. | NH3>HI>HCl |
9.已知某有机物X的结构简式如图所示,下列有关叙述不正确的是( )
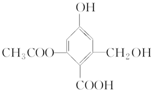

| A. | 1 mol X最多可与3 mol H2发生加成反应 | |
| B. | X在一定条件下能与FeCl3溶液发生显色反应 | |
| C. | X在一定条件下能发生消去反应和酯化反应 | |
| D. | 1 mol X分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗Na、NaOH、NaHCO3的物质的量分别为3 mol、4 mol、1 mol |
16.以下判断中不正确的是( )
| A. | 微粒半径:Fe2+>Fe3+ | |
| B. | 酸性:HClO4>H2SO4>H2SeO4 | |
| C. | 反应活泼性:O>03>02 | |
| D. | 物质的量浓度:pH相等时,CH3C00H>HCl0. |
1.粗盐提纯的实验中,不需要进行的操作是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
8.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 1molCH5+中含有的电子数目为11NA | |
| B. | 0.1mol/L AlCl3溶液中含有的Al3+数目一定小于0.1NA | |
| C. | 78gNa2O2和Na2S的混合物中含有的阴离子数目一定是NA | |
| D. | 常温下,1L PH=1的H2SO4溶液中,由水电离出的H+数目为0.1NA |
5. 如图所示,m表示溶液中生成沉淀的物质的量,n表示溶液中加入物质的量.下列反应中,能按照如图曲线进行的是( )
如图所示,m表示溶液中生成沉淀的物质的量,n表示溶液中加入物质的量.下列反应中,能按照如图曲线进行的是( )
 如图所示,m表示溶液中生成沉淀的物质的量,n表示溶液中加入物质的量.下列反应中,能按照如图曲线进行的是( )
如图所示,m表示溶液中生成沉淀的物质的量,n表示溶液中加入物质的量.下列反应中,能按照如图曲线进行的是( )| A. | 往Ca(OH)2和KOH的混合溶液中通入CO2 | |
| B. | 往AlCl3和NH4Cl的混合溶液中加NaOH溶液 | |
| C. | 往Al2(SO4)3和(NH4)2SO4的混合溶液中加Ba(OH)2溶液 | |
| D. | 往NH4Al(SO4)2溶液中加入NaOH溶液 |
6.将6.54g氧化铜与石墨的混合粉末隔绝空气加热,充分反应后,生成的气体用足量的NaOH溶液吸收,溶液增重1.32g.则原混合粉末中氧化铜的质量可能是( )
| A. | 2.4g | B. | 4.8g | C. | 6g | D. | 6.18g |