题目内容
17.常温下用 a L pH=3的HX溶液与 b L pH=11的氢氧化钠溶液相混合,下列叙述正确的是( )| A. | 若二者恰好中和,则一定是 a=b | B. | 若混合液显碱性,则一定是 b≥a | ||
| C. | 若混合液显中性,则一定是 a≤b | D. | 若混合液显酸性,则一定是 a>b |
分析 A.如果HX是强酸,则两者恰好完全中和a=b;
B.如果HX是弱酸,则a=b溶液呈酸性;
C.HA是弱酸,溶液呈中性,则a<b、HA是强酸,溶液呈中性,则a=b;
D.如果HX是弱酸,则a=b溶液呈酸性.
解答 解:A.如果HX是强酸,则两者恰好完全中和a=b,如果HX是弱酸,浓度越大的需要体积越小,所以体积a<b,故A错误;
B.如果HX是弱酸,则a=b溶液呈酸性,故B错误;
C.HA是弱酸,溶液呈中性,则a<b、HA是强酸,溶液呈中性,则a=b,所以一定是 a≤b,故C正确;
D.如果HX是弱酸,则a=b溶液呈酸性,而不是a>b,故D错误;
故选C.
点评 本题考查探究溶液酸碱性,为高考高频点,明确溶液中的溶质及其性质是解本题关键,注意CD采用逆推法分析解答较简便,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.根据下列热化学方程式,判断氢化物的稳定性顺序正确的是( )
$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)=NH3(g)△H=-46.19kJ•mol-1
$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g)△H=-92.36kJ•mol-1
$\frac{1}{2}$I2(g)+$\frac{1}{2}$H2(g)=HI(g)△H=-4.74kJ•mol-1.
$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)=NH3(g)△H=-46.19kJ•mol-1
$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g)△H=-92.36kJ•mol-1
$\frac{1}{2}$I2(g)+$\frac{1}{2}$H2(g)=HI(g)△H=-4.74kJ•mol-1.
| A. | HCl>NH3>HI | B. | HI>HCl>NH3 | C. | HCl>HI>NH3 | D. | NH3>HI>HCl |
8.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 1molCH5+中含有的电子数目为11NA | |
| B. | 0.1mol/L AlCl3溶液中含有的Al3+数目一定小于0.1NA | |
| C. | 78gNa2O2和Na2S的混合物中含有的阴离子数目一定是NA | |
| D. | 常温下,1L PH=1的H2SO4溶液中,由水电离出的H+数目为0.1NA |
5. 如图所示,m表示溶液中生成沉淀的物质的量,n表示溶液中加入物质的量.下列反应中,能按照如图曲线进行的是( )
如图所示,m表示溶液中生成沉淀的物质的量,n表示溶液中加入物质的量.下列反应中,能按照如图曲线进行的是( )
 如图所示,m表示溶液中生成沉淀的物质的量,n表示溶液中加入物质的量.下列反应中,能按照如图曲线进行的是( )
如图所示,m表示溶液中生成沉淀的物质的量,n表示溶液中加入物质的量.下列反应中,能按照如图曲线进行的是( )| A. | 往Ca(OH)2和KOH的混合溶液中通入CO2 | |
| B. | 往AlCl3和NH4Cl的混合溶液中加NaOH溶液 | |
| C. | 往Al2(SO4)3和(NH4)2SO4的混合溶液中加Ba(OH)2溶液 | |
| D. | 往NH4Al(SO4)2溶液中加入NaOH溶液 |
12.下列化学反应发生的原理一定相同的是( )
| A. | CH2=CH2和HCHO都能使溴水褪色 | |
| B. | CH4和苯都能够和氯单质发生反应 | |
| C. | 卤代烃与氢氧化钠水溶液或醇溶液发生反应 | |
| D. | 二氧化硫能使溴水或者酸性高锰酸钾溶液褪色 |
2.正确使用化学用语是学好化学的基础,下列化学用语正确的是( )
| A. |  的名称:1,4-二甲苯 的名称:1,4-二甲苯 | B. | 丙烷的分子式:CH3CH2CH3 | ||
| C. | 聚丙烯的链节:-CH2-CH2-CH2- | D. | H2S的电子式: |
9.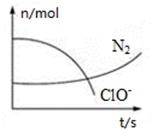 某反应体系中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种微粒,反应过程中测得ClO-和N2的物质的量随时间的变化如图所示.有关判断正确的是( )
某反应体系中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种微粒,反应过程中测得ClO-和N2的物质的量随时间的变化如图所示.有关判断正确的是( )
 某反应体系中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种微粒,反应过程中测得ClO-和N2的物质的量随时间的变化如图所示.有关判断正确的是( )
某反应体系中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种微粒,反应过程中测得ClO-和N2的物质的量随时间的变化如图所示.有关判断正确的是( )| A. | 氧化剂是ClO-,还原产物是HCO3- | |
| B. | 反应体系中反应物与生成物各有三种微粒 | |
| C. | 氧化剂与还原剂的物质的量之比为5:2 | |
| D. | 生成2.24L N2(标准状况)时转移电子0.5 mol |
6.将6.54g氧化铜与石墨的混合粉末隔绝空气加热,充分反应后,生成的气体用足量的NaOH溶液吸收,溶液增重1.32g.则原混合粉末中氧化铜的质量可能是( )
| A. | 2.4g | B. | 4.8g | C. | 6g | D. | 6.18g |
7.设NA表示阿伏加德罗常数的数值,下列叙述不正确的是( )
| A. | 1.5 g甲基所含有的电子数目为0.9NA | |
| B. | 在1L0.1 mol•L-1Na2S溶液中,阴离子总数大于0.1NA | |
| C. | 78g Na2O2与足量CO2完全反应,转移的电子总数为NA | |
| D. | 在KIO3+6HI=KI+3I2+3H2O反应中,每生成3 molI2,则转移6NA个电子 |