题目内容
18.铈、铬、钴、镍等过渡元素的单质及其化合物在工业生产中有着重要作用.(1)二氧化铈(CeO2)在平板电视显示屏中有着重要应用.CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在该反应中作氧化剂.
(2)自然界Cr主要以+3价和+6价存在.+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬.完成并配平下列离子方程式:
1Cr2O72-+3SO32-+8H+□═2Cr3++3SO42-+4H2O
(3)某锂离子电池用含有Li+的导电固体作为电解质.充电时,Li+还原为Li,并以原子形式嵌入电极材料C6中,以LiC6表示,电池反应为CoO2+LiC6?充电放电LiCoO2+C6放电时的正极反应式为CoO2+Li++e-=LiCoO2.
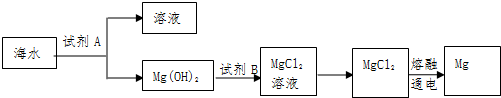
(4)NiSO4•6H2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得.操作步骤如下:

①向滤液I中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为FeS(aq)+Cu2+(aq)=Fe2+(aq)+CuS(aq).
②对滤液Ⅱ调pH的目的是除去Fe3+,原理是Fe3++3H2O?Fe(OH)3+3H+,已知25℃时Ksp[Fe(OH)3]=2.8×10-39,该温度下上述反应的平衡常数K=3.6×10-4.
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是增大NiSO4浓度,有利于蒸发结晶.
分析 (1)CeO2在稀硫酸和H2O2的作用下可生成Ce3+,Ce元素的化合价由+4价降低为+3价;
(2)从质量守恒、电荷守恒和电子守恒的角度配平方程式;
(3)根据电子和离子的定向移动方向判断电极;放电时,电池的正极发生还原反应,被CoO2还原生成LiCoO2;
(4)①加入FeS,可转化为溶解度更小的难溶电解质;
②Fe3++3H2O?Fe(OH)3+3H+,25℃时Ksp[Fe(OH)3]=2.8×10-39,Ksp=c(Fe3+)×c3(OH-),Kw=c(H+)×c(OH-),则K=$\frac{{c}^{3}({H}^{+})}{c(F{e}^{3+})}$=$\frac{{c}^{3}({H}^{+})}{c(F{e}^{3+})}$×$\frac{{c}^{3}(O{H}^{-})}{{c}^{3}(O{H}^{-})}$=$\frac{K{w}^{3}}{Ksp}$;
③滤液Ⅱ中含有Fe2+,可与过氧化氢发生氧化还原反应生成Fe3+,调节pH,可有利于Fe3+的水解.
解答 解:(1)CeO2在稀硫酸和H2O2的作用下可生成Ce3+,Ce元素的化合价由+4价降低为+3价,则CeO2在反应中作氧化剂,
故答案为:氧化;
(2)反应中Cr元素化合价由+6价降低到+3价,S元素化合价由+4价升高到+6价,则最小公倍数为12,由电子守恒和原子守恒、电荷守恒可知配平后的离子方程式为Cr2O72-+3SO32-+8H+═2Cr3++3SO42-+4H20,
故答案为:1;3;8H+;2;3;4;
(3)反应中电子向C6极移动,如C6为负极,则移向C6的离子应为阴离子,而移向C6的为阳离子,则C6应为阴极,此时该电池处于充电状态,放电时,电池的正极发生还原反应,被CoO2还原生成LiCoO2,电极方程式为CoO2+Li++e-=LiCoO2,
故答案为:CoO2+Li++e-=LiCoO2;
(4)①向滤液Ⅰ中加入FeS主要目的是除去Cu、Zn等杂质,说明CuS的溶解度更小,反应的离子方程式为FeS(aq)+Cu2+(aq)=Fe2+(aq)+CuS(aq),
故答案为:FeS(aq)+Cu2+(aq)=Fe2+(aq)+CuS(aq);
②Fe3++3H2O?Fe(OH)3+3H+,25℃时Ksp[Fe(OH)3]=2.8×10-39,Ksp=c(Fe3+)×c3(OH-),Kw=c(H+)×c(OH-),则K=$\frac{{c}^{3}({H}^{+})}{c(F{e}^{3+})}$=$\frac{{c}^{3}({H}^{+})}{c(F{e}^{3+})}$×$\frac{{c}^{3}(O{H}^{-})}{{c}^{3}(O{H}^{-})}$=$\frac{K{w}^{3}}{Ksp}$;
则K=$\frac{K{w}^{3}}{Ksp}$=$\frac{(1{0}^{-14})^{3}}{2.8×1{0}^{-39}}$=3.6×10-4,
故答案为:3.6×10-4;
③滤液Ⅲ溶质的主要成分是NiSO4,再加入碳酸钠过滤后,加稀硫酸溶解又生成NiSO4,可增大成NiSO4浓度,有利于蒸发结晶,
故答案为:增大NiSO4浓度,有利于蒸发结晶.
点评 本题考查较为综合,涉及氧化还原反应、盐类的水解、物质的分离提纯以及原电池知识,侧重于学生的分析能力和实验能力、计算能力的考查,为高频考点和常见题型,题目难度中等,注意把握基础知识的积累.

(1)下列关于氯水的叙述正确的是aef(填写符号).
a.氯水中存在两种电离平衡
b.向氯水中通入SO2,其漂白性增强
c.向氯水中通入氯气,c(H+)/c(ClO-)减小
d.加水稀释氯水,溶液中的所有离子浓度均减小
e.加水稀释氯水,水的电离平衡向正反应方向移动
f.向氯水中加入少量固体NaOH,可能有c(Na+)=c(Cl-)+c(ClO-)
(2)常温下,已知25℃时有关弱酸的电离平衡离数:
| 弱酸化学式 | HClO | H2CO3 |
| 电离平衡常数 | 4.7×10-8 | K1=4.3×10-7 K2=5.6×10-11 |
(3)电解饱和食盐水可得到溶质为M的碱溶液,常温下将浓度为c1的M溶液与0.1mol•L-1的一元酸HA等体积混合,所得溶液pH=7,则c1≤ 0.1mol•L-1(填“≥”、“≤”或“=”),溶液中离子浓度的大小关系为c(Na+)=c(A-)>c(OH-)=c(H+).若将上述“0.1mol•L-1的一元酸HA”改为“pH=1的一元酸HA”,所得溶液的pH仍为7,则c1≥0.1mol•L-1.
(4)牙釉质对牙齿起着保护作用,其主要成分为羟基磷灰石(Ca5(PO4)3OH),研究证实氟磷灰石(Ca5(PO4)3F)比它更能抵抗酸的侵蚀,故含氟牙膏已使全世界千百万人较少龋齿,请写出羟基磷灰石的溶度积常数表达式Ksp=c5(Ca2+)c3(PO43-)c(OH-),氟离子与之反应转化的离子方程式为Ca5(PO4)3OH+F-═Ca5(PO4)3F+OH-.
| A. | LiAlH4与乙醛作用生成乙醇,LiAlH4作还原剂 | |
| B. | LiAlH4与D2O反应,所得氢气的摩尔质量为4 g•mol-1 | |
| C. | 1 mol LiAlH4在125℃完全分解,转移3 mol电子 | |
| D. | LiAlH4与水反应生成三种物质时,化学方程式可表示为:LiAlH4+4H2O═Al(OH)3↓+LiOH+4H2↑ |
(1)配制250mL0.1mol/L的盐酸溶液
| 应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL | 除容量瓶、烧杯外还需要的其它玻璃仪器 |
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻线2-3cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是保证溶质全部转入容量瓶.
(4)若出现如下情况,对所配溶液浓度将有何影响?(填偏大、偏小、不变),没有进行A操作时浓度偏小;加蒸馏水时不慎超过了刻度线时浓度偏小;定容时俯视时浓度偏大.
| A. | 工业上可利用空气冷冻成液体后再分离来获得液氧 | |
| B. | 煤油燃烧后的主要产物是水和二氧化碳,绿色环保 | |
| C. | 煤油属于纯净物.主要成分是烃 | |
| D. | 火箭装载的燃料越多,说明其动力越大 |
| A. | 将滴管伸入试剂瓶中,然后用手指头捏紧橡胶乳头,赶走滴管中的空气 | |
| B. | 向烧杯内滴加试剂时,将滴管悬空放在烧杯上方,将试剂滴下 | |
| C. | 取液后的滴管保持橡胶乳头在上,不可倒置或平放 | |
| D. | 除滴瓶上的滴管外,用过的滴管应立即用清水冲洗干净 |
 X、Y、Z是中学化学中常见的单质或化合物,且X、Y、Z均含有同一种元素,它们能实现如图所示的转化关系(其他物质省略):
X、Y、Z是中学化学中常见的单质或化合物,且X、Y、Z均含有同一种元素,它们能实现如图所示的转化关系(其他物质省略):