题目内容
8.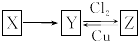 X、Y、Z是中学化学中常见的单质或化合物,且X、Y、Z均含有同一种元素,它们能实现如图所示的转化关系(其他物质省略):
X、Y、Z是中学化学中常见的单质或化合物,且X、Y、Z均含有同一种元素,它们能实现如图所示的转化关系(其他物质省略):(1)若X是一种生活中使用量最大的金属单质,写出Z与Cu反应的离子方程式2Fe3++Cu=2Fe2++Cu2+.
(2)若X是一种非金属单质,常温下为固体;Y是一种能使品红溶液褪色且加热后又能恢复原来颜色的化合物.写出Z和Cu反应的化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
分析 X、Y、Z是中学化学中常见的单质或化合物,且X、Y、Z均含有同一种元素,
(1)若X是一种生活中使用量最大的金属单质判断为Fe,铁为变价金属元素,Y和氯气反应生成Z证明Y未亚铁盐,Z为铁盐,Z与Cu反应为铁离子氧化铜生成亚铁离子和铜离子;
(2)若X是一种非金属单质,常温下为固体;Y是一种能使品红溶液褪色且加热后又能恢复原来颜色的化合物,判断Y为SO2,则X为S,Z为H2SO4.
解答 解:(1)若X是一种生活中使用量最大的金属单质判断为Fe,铁为变价金属元素,Y和氯气反应生成Z证明Y未亚铁盐,Z为铁盐,Z与Cu反应为铁离子氧化铜生成亚铁离子和铜离子,反应的离子方程式为:2Fe3++Cu═2Fe2++Cu2+,
故答案为:2Fe3++Cu═2Fe2++Cu2+;
(2)若X是一种非金属单质,常温下为固体;Y是一种能使品红溶液褪色且加热后又能恢复原来颜色的化合物,判断Y为SO2,则X为S,Z为H2SO4.Z和Cu反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
点评 本题考查无机物的推断,题目难度不大,本题注意根据反应的转化关系结合物质的相关性质为解答的突破口进行推断,牢固把握元素化合物知识是解答该类题目的前提,试题培养了学生的分析、理解能力及逻辑推理能力.

练习册系列答案
相关题目
18.下列叙述正确的是( )
| A. | 原子晶体中一定不存在化学键 | B. | 离子晶体中只存在离子键 | ||
| C. | 在共价化合物中一定有共价键 | D. | 非金属原子间只能形成共价化合物 |
19.在一定条件下,一定量的A和B气体发生如下可逆反应:A(g)+3B(g)?3C(g),只有反应到达平衡时才具有的性质是( )
| A. | 单位时间内消耗的A与生成的B物质的量之比为1:3 | |
| B. | 混合物各物质浓度的浓度相等 | |
| C. | 容器内A、B、C三种物质共存 | |
| D. | ν(A)、ν(B)、ν(C) 之比为1:3:3 |
16.在盛有少量氯水的试管中加入过量的溴化钾溶液,再加入少量四氯化碳,振荡静置后可观察到的现象是( )
| A. | 溶液呈橙色不分层 | B. | 溶液分两层,上层呈橙色 | ||
| C. | 溶液分两层,下层呈橙色 | D. | 溶液呈紫色不分层 |
3.下各项性质的比较中不正确的是( )
| A. | 原子半径:C<N<O<F | B. | 最高正化合价:Si<P<S<Cl | ||
| C. | 热稳定性:GeH4<SiH4<CH4 | D. | 酸性:H3CO3<H2SiO3<Ge(OH)4 |
13.化学上用“示踪原子法”来判断反应的历程,下列用“示踪原子法”表示的化学方程式正确的是( )
| A. | 2Na2O2+2H218O═4NaOH+18O2↑ | |
| B. | CH3COOH+CH3CH218OH→CH3COOCH2CH3+H218O | |
| C. | 5H218O2+2KMnO4+3H2SO4═518O2↑+K2SO4+2MnSO4+8H2O | |
| D. | K37ClO3+6HCl═K37Cl+3Cl2↑+3H2O |
20.下列各组顺序排列不正确的是( )
| A. | 最高正价:P<S<Cl | B. | 原子半径:O<S<Cl | ||
| C. | 酸性强弱:H2SiO3<H2CO3<HNO3 | D. | 失电子能力:Na>Mg>Al |
17.同周期或同主族元素中,不仅元素的基本性质呈周期性变化,而且它们的单质和化合物的性质也有一定的变化规律.
(1)在“比较钠、镁、铝金属活泼性”实验中,甲、乙两组的实验如下:
①写出钠和水反应的化学方程式2Na+2H2O═2NaOH+H2↑.
②写出铝和盐酸反应的离子方程式2Al+6H+═2Al3++3H2↑.
③钠、镁、铝金属活泼性由强到弱顺序是钠、镁、铝;甲、乙两组中,乙组的实验更可靠,另一组不可靠的原因没有除去金属表面的氧化膜,氧化铝性质稳定不易与酸反应.
(2)同周期元素中,氯比硫的非金属性强,下列叙述中不能证明这一事实的是BD.
A.向新制的饱和硫化氢溶液中通入氯气会产生淡黄色沉淀
B.常温时,氯气是气体,硫是固体
C.氯的最高价氧化物对应水化物的酸性比硫的强
D.氯气和硫分别跟氢气反应,生成的氢化物中氯和硫的化合价分别为-1、-2.
(1)在“比较钠、镁、铝金属活泼性”实验中,甲、乙两组的实验如下:
| 甲 组 | 乙 组 | ||
| 实验步骤 | 实验现象 | 实验步骤 | 实验现象 |
| 1.取两支试管,加入3mL水,各滴入2滴酚酞试液,分别加入一小粒金属钠和少量镁粉,观察现象. 将加入镁粉的试管加热至沸腾,观察现象. | 钠:在冷水中,浮于水面,熔成小球,四处游动,逐渐缩小,溶液很快变红色. 镁:在冷水中几乎无现象,加热至沸后产生大量气体,溶液变红. | 1.取两支试管,加入3mL水,各滴入2滴酚酞试液,分别加入一小粒金属钠和少量镁粉,观察现象. 将加入镁粉的试管加热至沸腾,观察现象. | 钠:在冷水中,浮于水面,熔成小球,四处游动,逐渐缩小,溶液很快变红色. 镁:在冷水中几乎无现象,加热至沸后产生大量气体,溶液变红. |
| 2.取一小块铝和一小块镁带,用砂纸擦去表面的氧化膜,分别同时投入盛有2mL1mol/L盐酸的两个试管中,观察现象. | 镁:剧烈反应,很快产生大量气体. 铝:也产生大量气体,但反应比镁慢. | 2.取一小块铝和一小块镁带,分别同时投入盛有2mL1mol/L盐酸的两个试管中,观察现象. | 镁:开始时没有现象,过一会儿产生大量气体. 铝:基本没有变化. |
②写出铝和盐酸反应的离子方程式2Al+6H+═2Al3++3H2↑.
③钠、镁、铝金属活泼性由强到弱顺序是钠、镁、铝;甲、乙两组中,乙组的实验更可靠,另一组不可靠的原因没有除去金属表面的氧化膜,氧化铝性质稳定不易与酸反应.
(2)同周期元素中,氯比硫的非金属性强,下列叙述中不能证明这一事实的是BD.
A.向新制的饱和硫化氢溶液中通入氯气会产生淡黄色沉淀
B.常温时,氯气是气体,硫是固体
C.氯的最高价氧化物对应水化物的酸性比硫的强
D.氯气和硫分别跟氢气反应,生成的氢化物中氯和硫的化合价分别为-1、-2.
