题目内容
9.运用化学反应原理研究卤族元素的性质具有重要意义.(1)下列关于氯水的叙述正确的是aef(填写符号).
a.氯水中存在两种电离平衡
b.向氯水中通入SO2,其漂白性增强
c.向氯水中通入氯气,c(H+)/c(ClO-)减小
d.加水稀释氯水,溶液中的所有离子浓度均减小
e.加水稀释氯水,水的电离平衡向正反应方向移动
f.向氯水中加入少量固体NaOH,可能有c(Na+)=c(Cl-)+c(ClO-)
(2)常温下,已知25℃时有关弱酸的电离平衡离数:
| 弱酸化学式 | HClO | H2CO3 |
| 电离平衡常数 | 4.7×10-8 | K1=4.3×10-7 K2=5.6×10-11 |
(3)电解饱和食盐水可得到溶质为M的碱溶液,常温下将浓度为c1的M溶液与0.1mol•L-1的一元酸HA等体积混合,所得溶液pH=7,则c1≤ 0.1mol•L-1(填“≥”、“≤”或“=”),溶液中离子浓度的大小关系为c(Na+)=c(A-)>c(OH-)=c(H+).若将上述“0.1mol•L-1的一元酸HA”改为“pH=1的一元酸HA”,所得溶液的pH仍为7,则c1≥0.1mol•L-1.
(4)牙釉质对牙齿起着保护作用,其主要成分为羟基磷灰石(Ca5(PO4)3OH),研究证实氟磷灰石(Ca5(PO4)3F)比它更能抵抗酸的侵蚀,故含氟牙膏已使全世界千百万人较少龋齿,请写出羟基磷灰石的溶度积常数表达式Ksp=c5(Ca2+)c3(PO43-)c(OH-),氟离子与之反应转化的离子方程式为Ca5(PO4)3OH+F-═Ca5(PO4)3F+OH-.
分析 (1)氯水中存在次氯酸的电离和水的电离两种电离平衡;向氯水中通入SO2,二者反应生成硫酸和盐酸,其漂白性减弱;当氯水饱和时再通氯气,c(H+)/c(ClO-)不变,若氯水不饱和再通氯气酸性增强会抑制次氯酸的电离,故比值增大;加水稀释氯水,溶液中的OH-浓度增大;加水稀释氯水,酸性减弱,对水的电离抑制作用减弱,故水的电离平衡向正反应方向移动;向氯水中加入少量固体NaOH,当溶液呈中性时,根据电荷守恒可推导出:c(Na+)=c(Cl-)+c(ClO-);
(2)由于次氯酸的酸性介于碳酸的两级电离常数之间,因此84消毒液露置在空气中与二氧化碳反应只能生成碳酸氢钠;
(3)电解NaCl的饱和水溶液生成氢气、氯气、氢氧化钠,若将浓度为c1 mol•L-1 的NaOH溶液与0.1mol?L-1 的一元酸HA等体积混合,所得溶液pH=7,HA可能为强酸,也可能为弱酸,若将上述“0.1mol•L-1的一元酸HA”改为“pH=1的一元酸HA”,所得溶液的pH仍为7,若为强酸c=0.1mol/L,若为弱酸c≥0.1mol/L,
(4)Ca5(PO4)3OH存在的沉淀溶解平衡为:Ca5(PO4)3OH?5Ca2++3PO43-+OH-,溶度积常数Ksp等于其电离出离子浓度幂次方乘积,由题意可知,反应离子方程式为:Ca5(PO4)3OH+F-=Ca5(PO4)3F+OH-.
解答 解:(1)a.氯水中存在次氯酸的电离和水的电离两种电离平衡,故a正确;
b.向氯水中通入SO2,二者反应生成硫酸和盐酸,其漂白性减弱,故b错误;
c.当氯水饱和时再通氯气,c(H+)/c(ClO-)不变,若氯水不饱和再通氯气酸性增强会抑制次氯酸的电离,故比值增大,故c错误;
d.加水稀释氯水,溶液中的OH-浓度增大,故d错误;
e.加水稀释氯水,酸性减弱,对水的电离抑制作用减弱,故水的电离平衡向正反应方向移动,故e正确;
f.向氯水中加入少量固体NaOH,当溶液呈中性时,根据电荷守恒可推导出:c(Na+)=c(Cl-)+c(ClO-),故f正确;
故答案为:aef;
(2)由于次氯酸的酸性介于碳酸的两级电离常数之间,因此84消毒液露置在空气中与二氧化碳反应只能生成碳酸氢钠,
离子方程式为:ClO-+CO2+H2O═HClO+HCO3-,生成的HClO不稳定,见光分解:2HClO$\frac{\underline{\;光照\;}}{\;}$2H++2Cl-+O2↑,
故答案为:ClO-+CO2+H2O═HClO+HCO3-;2HClO$\frac{\underline{\;光照\;}}{\;}$2H++2Cl-+O2↑;
(3)电解NaCl的饱和水溶液生成氢气、氯气、氢氧化钠,该反应的离子方程式:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-;
若将浓度为c1 mol•L-1 的NaOH溶液与0.1mol?L-1 的一元酸HA等体积混合,所得溶液pH=7,HA可能为强酸,也可能为弱酸,故c1≤0.1,溶液中c(OH-)=c(H+),由电荷守恒可知c(Na+)=c(A-),溶液中离子浓度大小为:c(Na+)=c(A-)>c(OH-)=c(H+),若将上述“0.1mol•L-1的一元酸HA”改为“pH=1的一元酸HA”,所得溶液的pH仍为7,若为强酸c=0.1mol/L,若为弱酸c≥0.1mol/L,
故答案为:≤;c(Na+)=c(A-)>c(OH-)=c(H+);≥;
(4)Ca5(PO4)3OH存在的沉淀溶解平衡为:Ca5(PO4)3OH?5Ca2++3PO43-+OH-,溶度积常数Ksp=c5(Ca2+)c3(PO43-)c(OH-),由题意可知,反应离子方程式为:Ca5(PO4)3OH+F-=Ca5(PO4)3F+OH-,
故答案为:c5(Ca2+)c3(PO43-)c(OH-);Ca5(PO4)3OH+F-═Ca5(PO4)3F+OH-.
点评 本题考查了弱电解质电离平衡、电解原理应用、溶度积常数的表达式、氯气性质等知识点,掌握基础是解题关键,题目难度中等.

| A. | 单位时间内消耗的A与生成的B物质的量之比为1:3 | |
| B. | 混合物各物质浓度的浓度相等 | |
| C. | 容器内A、B、C三种物质共存 | |
| D. | ν(A)、ν(B)、ν(C) 之比为1:3:3 |
| A. | 最高正价:P<S<Cl | B. | 原子半径:O<S<Cl | ||
| C. | 酸性强弱:H2SiO3<H2CO3<HNO3 | D. | 失电子能力:Na>Mg>Al |
(1)在“比较钠、镁、铝金属活泼性”实验中,甲、乙两组的实验如下:
| 甲 组 | 乙 组 | ||
| 实验步骤 | 实验现象 | 实验步骤 | 实验现象 |
| 1.取两支试管,加入3mL水,各滴入2滴酚酞试液,分别加入一小粒金属钠和少量镁粉,观察现象. 将加入镁粉的试管加热至沸腾,观察现象. | 钠:在冷水中,浮于水面,熔成小球,四处游动,逐渐缩小,溶液很快变红色. 镁:在冷水中几乎无现象,加热至沸后产生大量气体,溶液变红. | 1.取两支试管,加入3mL水,各滴入2滴酚酞试液,分别加入一小粒金属钠和少量镁粉,观察现象. 将加入镁粉的试管加热至沸腾,观察现象. | 钠:在冷水中,浮于水面,熔成小球,四处游动,逐渐缩小,溶液很快变红色. 镁:在冷水中几乎无现象,加热至沸后产生大量气体,溶液变红. |
| 2.取一小块铝和一小块镁带,用砂纸擦去表面的氧化膜,分别同时投入盛有2mL1mol/L盐酸的两个试管中,观察现象. | 镁:剧烈反应,很快产生大量气体. 铝:也产生大量气体,但反应比镁慢. | 2.取一小块铝和一小块镁带,分别同时投入盛有2mL1mol/L盐酸的两个试管中,观察现象. | 镁:开始时没有现象,过一会儿产生大量气体. 铝:基本没有变化. |
②写出铝和盐酸反应的离子方程式2Al+6H+═2Al3++3H2↑.
③钠、镁、铝金属活泼性由强到弱顺序是钠、镁、铝;甲、乙两组中,乙组的实验更可靠,另一组不可靠的原因没有除去金属表面的氧化膜,氧化铝性质稳定不易与酸反应.
(2)同周期元素中,氯比硫的非金属性强,下列叙述中不能证明这一事实的是BD.
A.向新制的饱和硫化氢溶液中通入氯气会产生淡黄色沉淀
B.常温时,氯气是气体,硫是固体
C.氯的最高价氧化物对应水化物的酸性比硫的强
D.氯气和硫分别跟氢气反应,生成的氢化物中氯和硫的化合价分别为-1、-2.
 2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:
2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题: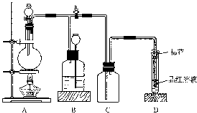 如图所示装置为铜跟浓硫酸反应制取二氧化硫的实验装置:
如图所示装置为铜跟浓硫酸反应制取二氧化硫的实验装置: