题目内容
18.海洋资源的利用具有广阔前景(1)如图是从海水中提取镁的简单流程.
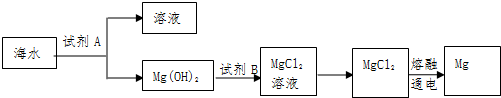
工业上常用于沉淀Mg2+的试剂A是石灰乳或氧化钙,Mg(OH)2转化为MgCl2的离子方程式是Mg(OH)2+2H+=Mg2++2H2O.
(2)海带灰中富含以I-形式存在的碘元素,实验室提取I2的途径如下所示:
干海带$\stackrel{灼烧}{→}$海带灰$→_{过滤}^{水}$滤液$→_{过氧化氢溶液}^{酸化}$$\stackrel{CCl_{4}}{→}$$\stackrel{多步操作}{→}$I2
①灼烧海带至灰烬时所用的主要仪器名称是坩埚.
②反应结束后,加入CCl4作萃取剂,采用萃取-分液的方法从碘水中提取碘,主要操作步骤如图:
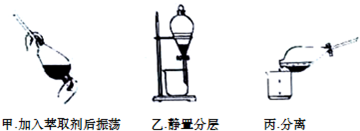
甲、乙、丙3步实验操作中,不正确的是丙(填“甲”、“乙”或“丙”).
分析 (1)海水中加入试剂A为氢氧化钙,沉淀镁离子生成氢氧化镁沉淀,过滤后在沉淀中 加入盐酸溶解得到氯化镁溶液,通过蒸发浓缩、冷却结晶过滤洗涤得到氯化镁晶体,在氯化氢气流中失水得到固体氯化镁,电解熔融氯化镁得到金属镁,
工业上常用石灰乳或氧化钙和镁离子反应生成Mg(OH)2;氢氧化镁和盐酸反应得到氯化镁和水;
(2)干海带在坩埚内灼烧得到海带灰,加入水溶解过滤后在滤液中加入酸化的过氧化氢得到含碘单质的溶液,加入四氯化碳萃取分液,蒸馏得到碘单质,
①灼烧固体时所用的主要仪器名称是坩埚;
②分离时先分离下层液体.
解答 解:(1)①工业上常用石灰乳或氧化钙沉淀Mg2+,CaO和H2O反应生成Ca(OH)2,Ca(OH)2和镁离子反应生成Mg(OH)2;氢氧化镁和盐酸反应得到氯化镁和水,反应的化学方程式为:Mg(OH)2+2HCl=MgCl2+2H2O,所以离子方程式为Mg(OH)2+2H+=Mg2++2H2O,
故答案为:石灰乳或氧化钙;Mg(OH)2+2H+=Mg2++2H2O;
(2)①灼烧固体时所用的主要仪器名称是坩埚,故答案为:坩埚;
②振荡、静置分层操持合理,而分离时先分离下层液体后倒出上层液体,则丙图不合理,故答案为:丙.
点评 本题考查了海水资源的综合运用,根据化学反应的概念及流程图中物质的性质来分析解答,侧重分离和萃取的考查,题目难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
6.将1mol碳在氧气中完全燃烧生成气体,放出393kJ的热量,下列热化学方程式表示正确的是( )
| A. | C(s)+O2(g)→CO2(g)+393kJ | B. | C+O2→CO2+393kJ | ||
| C. | C(s)+O2(g)→CO2(g)-393kJ | D. | C(s)+1/2O2(g)→CO(g)+393kJ |
3.与标况下11.2L的CO2所含氧原子数相等的水的质量为( )
| A. | 44g | B. | 22g | C. | 18g | D. | 9g |
10.反应Br+H2?HBr+H的能量对反应历程的关系如图,则下列叙述中正确的是( )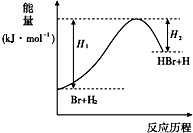

| A. | 正反应为放热反应 | |
| B. | 反应物总能量高于生成物总能量 | |
| C. | 升高温度可增大正反应速率,降低逆反应速率 | |
| D. | 加入催化剂,该化学反应的反应物的总能量与生成物的总能量差不改变 |


 请回答下列问题:
请回答下列问题: