题目内容
14. 某中学化学实验小组为了证明和比较SO2与氯水的漂白性,设计了如下装置:
某中学化学实验小组为了证明和比较SO2与氯水的漂白性,设计了如下装置:(1)实验室常用装置E制备Cl2,指出该反应中浓盐酸所表现出的性质酸性、还原性.
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管加热,两个试管中的现象分别为:B溶液由无色变成红色,D溶液没有明显变化仍无色.
(3)装置C的作用是吸收多余的SO2和Cl2,防止污染环境.
(4)如果把C中溶液换成蒸馏水,写出有关反应的离子方程式:
SO2+Cl2+2H2O=SO42-+2Cl-+4H+.
分析 (1)根据氯元素的化合价判断其表现的性质;
(2)次氯酸的漂白性是利用次氯酸的强氧化性,二氧化硫的漂白性是利用二氧化硫和有色物质生成无色物质,注意次氯酸的漂白性是永久性的,二氧化硫的漂白性是暂时的;
(3)根据氢氧化钠及二氧化硫和氯气的性质分析;
(4)如果把C中溶液换成蒸馏水,生成的氯气和二氧化硫发生氧化还原反应生成硫酸和盐酸;
解答 解:(1)实验室制取氯气的反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,由HCl生成MnCl2,氯元素化合价不变,由HCl生成Cl2,氯元素化合价升高,所以浓盐酸所表现出的性质是酸性和还原性,
故答案为:酸性,还原性;
(2)次氯酸的漂白性是利用次氯酸的强氧化性,二氧化硫的漂白性是利用二氧化硫和有色物质生成无色物质,次氯酸的漂白性是永久性的,二氧化硫的漂白性是暂时的;加热时,次氯酸漂白过的溶液无变化,二氧化硫和有色物质生成的无色物质不稳定,加热时能重新变成红色,
故答案为:溶液由无色变成红色;溶液没有明显变化仍无色;
(3)氯气和二氧化硫有毒,不能排放到空气中,但氯气和二氧化硫都和碱反应,所以装置C的作用是保证安全,吸收多余的氯气和二氧化硫,
故答案为:吸收多余的SO2和Cl2,防止污染环境;
(4)如果把C中溶液换成蒸馏水,生成的氯气和二氧化硫发生氧化还原反应生成硫酸和盐酸,反应的离子方程式为:SO2+Cl2+2H2O=SO42-+2Cl-+4H+,
故答案为:SO2+Cl2+2H2O=SO42-+2Cl-+4H+;
点评 本题考查了次氯酸和二氧化硫的漂白性,题目难度中等,注意次氯酸和二氧化硫漂白性的不同,次氯酸的漂白性是利用其强氧化性,二氧化硫的漂白性是利用二氧化硫和有色物质反应生成无色物质.

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案| A. | 12.1% | B. | 72.6% | C. | 84.7% | D. | 6.05% |
| A. | 氧化剂与还原剂的物质的量之比为1:4 | |
| B. | O2F2既是氧化剂又是还原剂 | |
| C. | 若生成4.48 L HF,则转移0.8 mol电子 | |
| D. | 氧气是还原产物 |
| A. | Al3+、Ba2+、Cl-、NO3- | B. | K+、OH-、Cl-、SO42- | ||
| C. | Ca2+、Mg2+、NO3-、HCO3- | D. | Na+、Cl-、CO32-、SO32- |
| A. | pH=1 的 NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) | |
| B. | 0.1 mol•L-1NaHCO3溶液与 0.1 mol•L-1NaOH 溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) | |
| C. | CH3COONa 和 CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) | |
| D. | 含等物质的量的 NaHC2O4和 Na2C2O4的溶液:2 c(Na+)=3c(HC2O4-)+3c(C2O42-)+3c(H2C2O4) |
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是NaOH溶液,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)实验室溶解该熔融物,下列试剂中最好的是B(填序号).
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
 (4)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为H++OH-═H2O.
(4)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为H++OH-═H2O.(5)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为NH4++OH-═NH3•H2O,上述现象说明溶液中Al3+、Fe3+、H+结合OH-的能力比NH4+强(填离子符号).
(6)B点对应的沉淀的物质的量为0.032mol,C点对应的氢氧化钠溶液的体积为7mL.
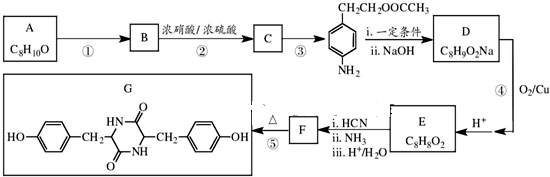
 有机物A的结构简式为
有机物A的结构简式为 ,G的分子式为C7H12O,以下A~H均为有机物,其转化关系如下:
,G的分子式为C7H12O,以下A~H均为有机物,其转化关系如下:
 可以发生消去反应
可以发生消去反应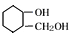 ,由F到G的反应类型为消去反应.
,由F到G的反应类型为消去反应.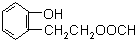 和
和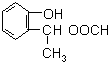 (不考虑立体异构).
(不考虑立体异构). .
.
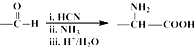 ,NO2$\stackrel{Fe?HCl}{→}$NH2
,NO2$\stackrel{Fe?HCl}{→}$NH2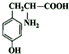 .
.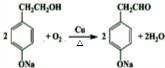 .
.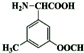 .
.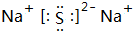 ,D原子的质子数和中子数相等,D的原子组成符号为1632 S.
,D原子的质子数和中子数相等,D的原子组成符号为1632 S.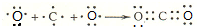 .
.