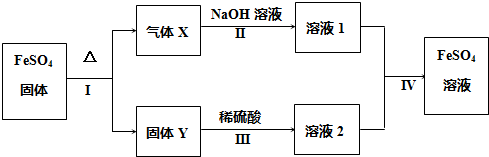
题目内容
2.现有甲酸、乙醛、丙酸甲酯(CH3CH2COOCH3)、2-甲基-1-戊烯组成的混合物中,测得其中氧的质量分数为15.3%,则氢的质量分数为( )| A. | 12.1% | B. | 72.6% | C. | 84.7% | D. | 6.05% |
分析 在甲酸(CH2O2)、乙醛(C2H4O)、丙酸甲酯(C4H8O2)、2-甲基-1-戊烯(C6H12)组成的混合物中,C、H两种元素的原子个数始终是1:2,故C、H两元素的质量之比=12:2=6:1,根据氧元素质量计算C、H元素的总质量分数,进而计算H元素质量分数.
解答 解:在甲酸(CH2O2)、乙醛(C2H4O)、丙酸甲酯(C4H8O2)、2-甲基-1-戊烯(C6H12)组成的混合物中,C、H两种元素的原子个数始终是1:2,故C、H两元素的质量之比=12:2=6:1,测得其中氧的质量分数为15.3%,则C、H元素的总质量分数为1-15.3%=84.7%,则氢的质量分数为84.7%×$\frac{1}{7}$=12.1%,
故选A.
点评 本题考查混合物中元素的质量分数的计算,关键是利用个组分的分子式确定C、H的固定组成,难度中等,侧重考查学生的思维能力.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目
13.二氟甲烷是优异的环保产品,它可替代某些会破坏臭氧层的“氟利昂”产品,用作空调和冷冻库致冷剂.二氟甲烷的结构有( )
| A. | 4种 | B. | 3种 | C. | 2种 | D. | 1种 |
7.下列说法正确的是( )
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 任何放热反应在常温下一定能发生反应 | |
| C. | 放热反应不需要加热就能发生 | |
| D. | 吸热反应在常温下也能发生 |
11.实验室需用480mL0.10mol/L的硫酸铜溶液,以下操作正确的是( )
| A. | 将12.00g胆矾配成500mL溶液 | |
| B. | 称取7.68g硫酸铜,加入500mL水 | |
| C. | 将12.50g胆矾溶于少量水中,再用水稀释至500mL | |
| D. | 在80mL0.6mol/L CuSO4溶液中加入400mL水 |
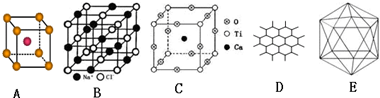
 有A、B、C、D四种元素,A元素的原子的所有能级具有相同的电子数,由B元素形成的单质在常温常压为易挥发的液体,可从海水是提取,C及其合金是人类最早使用的金属材料.D与A位于同一主族,是构成地球上矿物质的主要元素.请回答下列问题:
有A、B、C、D四种元素,A元素的原子的所有能级具有相同的电子数,由B元素形成的单质在常温常压为易挥发的液体,可从海水是提取,C及其合金是人类最早使用的金属材料.D与A位于同一主族,是构成地球上矿物质的主要元素.请回答下列问题: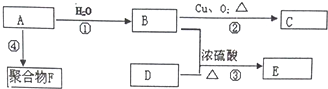
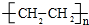 .
.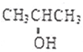 化学性质与B相似,试写出
化学性质与B相似,试写出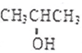 在有催化剂和加热条件下与O2反应的化学方程式:2
在有催化剂和加热条件下与O2反应的化学方程式:2 某中学化学实验小组为了证明和比较SO2与氯水的漂白性,设计了如下装置:
某中学化学实验小组为了证明和比较SO2与氯水的漂白性,设计了如下装置: