题目内容
14.短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,其中A为地壳中含量最高的金属元素.
请用化学用语回答下列问题:
(1)E元素在周期表中的位置:第3周期ⅦA族
(2)A、D、E元素简单离子半径由大到小的顺序为Cl->O2->Al3+(填微粒符号)
(3)F与D同主族且相邻,二者气态氢化物稳定性的大小关系为H2O>H2S(填微粒符号)
(4)用高能射线照射含有10电子的D元素氢化物分子时,一个分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,试写出阳离子的电子式:
 .该阳离子中存在的化学键有共价键.
.该阳离子中存在的化学键有共价键.(5)由C、E两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里C、E两种原子最外层均达到8个电子的稳定结构.甲遇水蒸气可形成一种常见的漂白性物质.则甲的结构式为
 .
.
分析 短周期主族元素中,A为地壳中含量最高的金属元素,则A为Al元素,由元素在周期表中的相对位置,可知B为碳元素、C为N元素、D为O元素、E为Cl.
(1)主族元素周期数=原子电子层数、主族族序数=原子最外层电子数;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,离子的电子层越多离子半径越大;
(3)F与D同主族且相邻,则F为S元素,同主族自上而下非金属性减弱,氢化物稳定性与元素非金属性一致;
(4)用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,应为H2O+;
(5)由N、Cl两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里N、Cl两种原子最外层均达到8个电子的稳定结构,则N、Cl个数比应为1:3,甲为NCl3.
解答 解:短周期主族元素中,A为地壳中含量最高的金属元素,则A为Al元素,由元素在周期表中的相对位置,可知B为碳元素、C为N元素、D为O元素、E为Cl.
(1)E为Cl元素,原子核外有3个电子层,最外层电子数为67,处于周期表中第3周期ⅦA族,
故答案为:第3周期ⅦA族;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,离子的电子层越多离子半径越大,故离子半径:Cl->O2->Al3+,
故答案为:Cl-;O2-;Al3+;
(3)F与D同主族且相邻,则F为S元素,同主族自上而下非金属性减弱,氢化物稳定性与元素非金属性一致,故氢化物稳定性H2O>H2S,
故答案为:H2O;H2S;
(4)用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,应为H2O+,电子式为: ,含有的化学键为共价键,
,含有的化学键为共价键,
故答案为: ;共价键;
;共价键;
(5)由N、Cl两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里N、Cl两种原子最外层均达到8个电子的稳定结构,则N、Cl个数比应为1:3,甲遇水蒸气可形成一种常见的漂白性物质应为次氯酸,所以在甲中氯显+1价,所以甲的结构式为 ,
,
故答案为: .
.
点评 本题考查元素周期表与元素周期律应用、化学用语、元素化合物性质等,熟练掌握周期表的结构,侧重考查学生知识迁移应用与分析推理能力,难度中等.

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案| A. | Z2+能促进水的电离 | |
| B. | 常见单质的熔点:X>Z>Y | |
| C. | 若元素R的某种微粒R2-,则R不一定与Y同主族 | |
| D. | Y与W组成的二元化合物是制耐高温坩埚的常用材料 |
| A. | 目前使用的燃料液化石油气,其主要成分均属于烯烃 | |
| B. | 食用白糖的主要成分是蔗糖,小苏打的主要成分是碳酸钠 | |
| C. | 用碱式滴定管量取20.00mL0.1mol/LKMnO4溶液 | |
| D. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 |
| A. | 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA | |
| B. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,转移2NA个电子 | |
| C. | 标准状况下,2.24L辛烷中所含极性共价键的数目为1.8 NA | |
| D. | 电镀铜时,若阴极得到电子数为2NA个,则阳极质量减少64g |
| A. | 工业上常用电解法制备元素C、D、E的单质 | |
| B. | 一定条件下,元素C、D的最高价氧化物对应的水化物之间不能发生反应 | |
| C. | 化合物AE与CE具有相同类型的化学键 | |
| D. | 元素A、B组成的化合物常温下一定呈气态 |
| A. | 汽油是纯净物,乙醇汽油是混合物 | |
| B. | 苯、乙烯、乙酸和乙酸乙酯都能发生加成反应 | |
| C. | 石油的分馏和煤的干馏都发生了化学变化 | |
| D. | 除去乙酸乙酯中少量的乙酸,用饱和碳酸钠溶液洗涤后分液 |

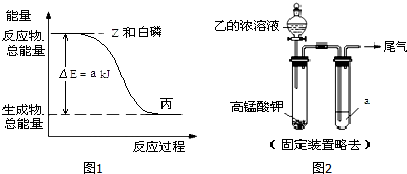
 .
. .白磷固体和 Z 气体反应,生成 1mol 液态丙时,能量变化如图1所示,写出该反应的热化学方程式:$\frac{1}{4}$P4(s)+$\frac{3}{2}$Cl2(g)=PCl3(l)△H=-a kJ/mol.已知 1mol 白磷固体和 Z 气体反应,生成固态丁时,放热 bkJ,则 1mol 固态丁转化为液态丙时的反应热△H=(a-$\frac{b}{4}$ )kJ/mol.
.白磷固体和 Z 气体反应,生成 1mol 液态丙时,能量变化如图1所示,写出该反应的热化学方程式:$\frac{1}{4}$P4(s)+$\frac{3}{2}$Cl2(g)=PCl3(l)△H=-a kJ/mol.已知 1mol 白磷固体和 Z 气体反应,生成固态丁时,放热 bkJ,则 1mol 固态丁转化为液态丙时的反应热△H=(a-$\frac{b}{4}$ )kJ/mol.