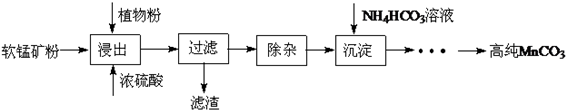
题目内容
6.X、Y、Z 为不同短周期非金属元素的气态单质.在一定条件下能发生如下反应:Y+X→甲(g),Y+Z→乙(g).甲、乙可化合生成离子化合物,甲的相对分子质量小于乙.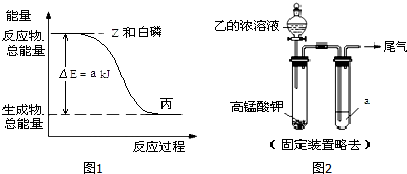
(1)X 的电子式是
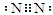 .
.(2)白磷(P4)在 Z 气体中燃烧可生成液态丙分子,也可生成固态丁分子.已知丙分子中各原子最外层均是 8 电子结构,丙的结构式是
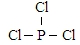 .白磷固体和 Z 气体反应,生成 1mol 液态丙时,能量变化如图1所示,写出该反应的热化学方程式:$\frac{1}{4}$P4(s)+$\frac{3}{2}$Cl2(g)=PCl3(l)△H=-a kJ/mol.已知 1mol 白磷固体和 Z 气体反应,生成固态丁时,放热 bkJ,则 1mol 固态丁转化为液态丙时的反应热△H=(a-$\frac{b}{4}$ )kJ/mol.
.白磷固体和 Z 气体反应,生成 1mol 液态丙时,能量变化如图1所示,写出该反应的热化学方程式:$\frac{1}{4}$P4(s)+$\frac{3}{2}$Cl2(g)=PCl3(l)△H=-a kJ/mol.已知 1mol 白磷固体和 Z 气体反应,生成固态丁时,放热 bkJ,则 1mol 固态丁转化为液态丙时的反应热△H=(a-$\frac{b}{4}$ )kJ/mol.(3)某同学拟用图2所示装置证明氧化性 Z>I2,已知高锰酸钾与乙的浓溶液反应生成Z,则 a 是淀粉KI的水溶液.若仅将 a 换为甲的浓溶液,实验时会产生大量白烟并有气体单质生成,该反应的化学方程式是8NH3+3Cl2=6NH4Cl+N2.
(4)向一定浓度的 BaCl2 溶液中通入 SO2气体,未见沉淀生成,若在通入 SO2气体的同时加入由 X、Y、Z 中的一种或几种元素组成的某纯净物,即可生成白色沉淀,该纯净物可能是Cl2、NH3.
分析 X、Y、Z为不同短周期非金属元素的气态单质,Y+X→甲(g),Y+Z→乙(g).甲、乙可化合生成离子化合物,则该化合物为NH4Cl,甲的相对分子质量小于乙,则甲为NH3,乙为HCl,Y为H2,X为N2,Z为Cl2.
(1)X为N2,氮原子之间有3对共用电子对;
(2)白磷(P4)在氯气中燃烧可生成液态丙为PCl3,生成固体丁为PCl5,其中PCl3分子中各原子最外层均是8电子结构,P原子与Cl原子之间形成1对共用电子对;
由图可知,白磷固体和氯气反应生成PCl3的反应为放热反应,注明物质的聚集状态与反应热书写热化学方程式;
根据盖斯定律计算1mol 固态丁转化为液态丙时的反应热;
(3)氯气的氧化性大于碘的氧化性,将氯气通入淀粉KI溶液中生成碘单质,溶液变蓝;氯气具有强氧化性,与过量氨气反应生成NH4Cl和N2;
(4)若在通入SO2气体的同时加入Cl2,发生反应为SO2+Cl2+2H2O═H2SO4+2HCl,若在通入SO2气体的同时加入NH3,溶液中存在大量的SO3-.
解答 解:X、Y、Z为不同短周期非金属元素的气态单质,Y+X→甲(g),Y+Z→乙(g).甲、乙可化合生成离子化合物,则该化合物为NH4Cl,甲的相对分子质量小于乙,则甲为NH3,乙为HCl,Y为H2,X为N2,Z为Cl2.
(1)X为N2,氮原子之间有3对共用电子对,电子式为: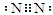 ,
,
故答案为: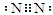 ;
;
(2)白磷(P4)在氯气中燃烧可生成液态丙为PCl3,生成固体丁为PCl5,其中PCl3分子中各原子最外层均是8电子结构,P原子与Cl原子之间形成1对共用电子对,结构简式为: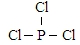 ;
;
由图可知,白磷固体和氯气反应生成1mol PCl3 时放出热量为a kJ,反应热化学方程式为:$\frac{1}{4}$P4(s)+$\frac{3}{2}$Cl2(g)=PCl3(l)△H=-a kJ/mol;
1mol 白磷固体和 氯气 气体反应,生成固态PCl5时放热 bkJ,则反应热化学方程式为:$\frac{1}{4}$P4(s)+$\frac{5}{2}$Cl2(g)=PCl5(s)△H=-$\frac{b}{4}$ kJ/mol,
根据盖斯定律,可得:PCl5(s)=(g)=PCl3(l)+Cl2(g)△H=(a-$\frac{b}{4}$ )kJ/mol,
故答案为: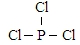 ;$\frac{1}{4}$P4(s)+$\frac{3}{2}$Cl2(g)=PCl3(l)△H=-a kJ/mol;(a-$\frac{b}{4}$ )kJ/mol;
;$\frac{1}{4}$P4(s)+$\frac{3}{2}$Cl2(g)=PCl3(l)△H=-a kJ/mol;(a-$\frac{b}{4}$ )kJ/mol;
(3)氯气的氧化性大于碘的氧化性,将氯气通入淀粉KI溶液中生成碘单质,溶液变蓝,即a溶液为淀粉KI溶液,
氯气具有强氧化性,与过量氨气反应生成NH4Cl和N2,反应的方程式为8NH3+3Cl2=6NH4Cl+N2,
故答案为:淀粉KI;8NH3+3Cl2=6NH4Cl+N2;
(4)若在通入SO2气体的同时加入Cl2,发生反应为SO2+Cl2+2H2O═H2SO4+2HCl,在BaCl2溶液中生成BaSO4沉淀,若在通入SO2气体的同时加入NH3,溶液中存在大量的SO3-,可生成沉淀BaSO3,
故答案为:Cl2、NH3.
点评 本题考查较为综合,涉及无机物的推断、电子式、热化学方程式、氧化性的比较等问题,侧重考查学生对知识的迁移运用能力的考查,需要学生具备扎实的基础.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 1mol•L-1 | B. | 2mol•L-1 | C. | 3mol•L-1 | D. | 4mol•L-1 |
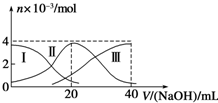
| A. | 等浓度的NaOH溶液与H2A溶液按2:1混合后,其溶液中水的电离程度比纯水大 | |
| B. | 当V(NaOH)=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-) | |
| C. | NaHA溶液中:c(OH-)=c(H+)+c(HA-)+2c(H2A) | |
| D. | 向上述加入20mLNaOH溶液后所得溶液中再加入水的过程中,pH可能减少 |
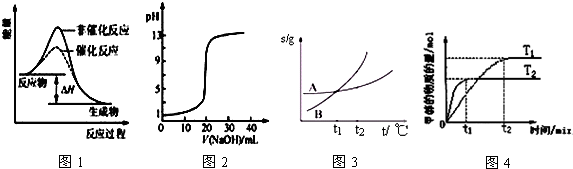
| A. | 图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| B. | 图2表示0.1000 mol•L-1NaOH溶液滴定20.00mL0.1000 mol•L-1CH3COOH溶液所得到的滴定曲线 | |
| C. | 图3表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B=A | |
| D. | 图4表示在其他条件相同时,分别在T1、T2温度下由CO2和H2合成甲醇的物质的量随时间变化情况,则CO2和H2合成甲醇是吸热反应 |
| A. | 分别用H2O2、KMnO4分解制O2,当制得等质量O2时,转移电子数之比为1:2 | |
| B. | 等质量的O2与O3中,氧原子的个数比为3:2 | |
| C. | CaCl2及CaO2固体中阴、阳离子数之比均为2:1 | |
| D. | 10mL 0.3mol/LNaCl与30mL0.1mol/LAlCl3溶液中Cl-物质的量浓度比为1:3 |
| A. | 溴苯和水 | B. | 甘油和水 | C. | 乙醇和乙二醇 | D. | 乙酸和乙醇 |

 .该阳离子中存在的化学键有共价键.
.该阳离子中存在的化学键有共价键. .
.

 ,在一定条件下Y与BrCl(一氯化溴,与卤素单质性质相似)按物质的量1:1发生加成反应,生成的产物可能有6种.
,在一定条件下Y与BrCl(一氯化溴,与卤素单质性质相似)按物质的量1:1发生加成反应,生成的产物可能有6种. .
. (不考虑立体异构).
(不考虑立体异构). 为有机原料制备化合物
为有机原料制备化合物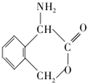 的合成路线流程图(无机试剂任选).
的合成路线流程图(无机试剂任选).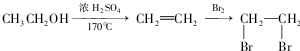 )
)