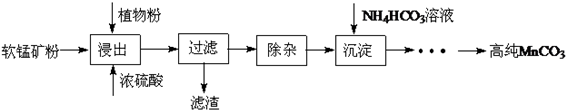
题目内容
9.NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA | |
| B. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,转移2NA个电子 | |
| C. | 标准状况下,2.24L辛烷中所含极性共价键的数目为1.8 NA | |
| D. | 电镀铜时,若阴极得到电子数为2NA个,则阳极质量减少64g |
分析 A、溶液体积不明确;
B、钠反应后变为+1价;
C、标况下辛烷为液态;
D、电镀铜时,阳极上铜放电:Cu-2e-=Cu2+.
解答 解:A、溶液体积不明确,故溶液中的氢氧根的个数无法计算,故A错误;
B、钠反应后变为+1价,故1mol钠反应后一定转移NA个电子,与产物无关,故B错误;
C、标况下辛烷为液态,故不能计算其物质的量和含有的极性共价键个数,故C错误;
D、电镀铜时,阳极上铜放电:Cu-2e-=Cu2+,故当阴质量减少极上得到2NA个电子时,阳极上失去2NA个电子,则阳极上反应掉1mol铜,故质量减少64g,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
20.表是元素周期表的一部分.
根据①~⑫元素在周期表中的位置,回答下列有关问题:(请用化学符号填写)
(1)写出下列元素符号:①N,⑥Si.
(2)在这些元素的最高价氧化物对应水化物中,酸性最强的是HClO4,呈两性的氢氧化物是Al(OH)3.(用化学式填写)
(3)在这些元素中单质的氧化性最强的是F2,还原性最强的是K.化学性质最不活泼的元素是Ar.(用化学式填写)
(4)用电子式表示⑦和⑩形成化合物的过程: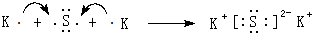 .
.
(5)⑦和⑧分别形成的气态氢化物中相对不稳定的是H2S.
根据①~⑫元素在周期表中的位置,回答下列有关问题:(请用化学符号填写)
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)在这些元素的最高价氧化物对应水化物中,酸性最强的是HClO4,呈两性的氢氧化物是Al(OH)3.(用化学式填写)
(3)在这些元素中单质的氧化性最强的是F2,还原性最强的是K.化学性质最不活泼的元素是Ar.(用化学式填写)
(4)用电子式表示⑦和⑩形成化合物的过程:
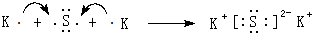 .
.(5)⑦和⑧分别形成的气态氢化物中相对不稳定的是H2S.
17.常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)所示.根据图示判断,下列说法正确的是( )

| A. | 等浓度的NaOH溶液与H2A溶液按2:1混合后,其溶液中水的电离程度比纯水大 | |
| B. | 当V(NaOH)=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-) | |
| C. | NaHA溶液中:c(OH-)=c(H+)+c(HA-)+2c(H2A) | |
| D. | 向上述加入20mLNaOH溶液后所得溶液中再加入水的过程中,pH可能减少 |
19.化学与科学、技术、社会、环境密切相关.下列有关说法中不正确的是( )
| A. | 屠呦呦女士利用乙醚萃取青蒿素获得了2015年度诺贝尔生理学或医学奖,为人类防治疟疾作出了重大贡献 | |
| B. | 光导纤维应避免在强碱性环境中使用 | |
| C. | 硅胶多孔、吸水能力强,常用作袋装食品的干燥 | |
| D. | 陶瓷、水泥、玻璃、大理石属于硅酸盐产品 |
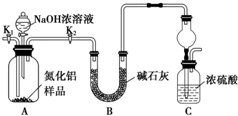
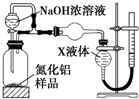
 d.NH4Cl溶液
d.NH4Cl溶液

 .该阳离子中存在的化学键有共价键.
.该阳离子中存在的化学键有共价键. .
.

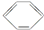
 ,在一定条件下Y与BrCl(一氯化溴,与卤素单质性质相似)按物质的量1:1发生加成反应,生成的产物可能有6种.
,在一定条件下Y与BrCl(一氯化溴,与卤素单质性质相似)按物质的量1:1发生加成反应,生成的产物可能有6种. .
.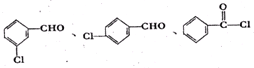 (不考虑立体异构).
(不考虑立体异构).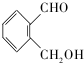 为有机原料制备化合物
为有机原料制备化合物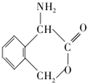 的合成路线流程图(无机试剂任选).
的合成路线流程图(无机试剂任选).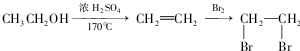 )
)