题目内容
12.亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,使用过量会使人中毒,国际上对食品中亚硝酸钠的用量控制在很低的水平上.某学习小组针对亚硝酸钠设计了如下实验:实验Ⅰ制备NaNO2
该小组查阅资料知:2NO+Na2O2═2NaNO2;2NO2+Na2O2═2NaNO3
设计制备装置如下(夹持装置略去):
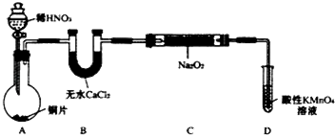
(1)如果没有B装置,C中发生的副反应有2Na2O2+2H2O=4NaOH+O2↑,2NO+O2=2NO2.
(2)装置D可将剩余的NO氧化成NO3-,发生反应的离子方程式为5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O.
(3)甲同学检查完装置气密性良好后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质.于是在A与B装置间增加了在A、B之间增加装有水的洗气瓶装置,改进后提高了NaNO2的纯度.
实验Ⅱ测定制取的样品中NaNO2的含量
步骤:a.在5个有编号的带刻度试管(比色管)中分别加入不同量的NaNO2溶液,各加入1mL的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为10mL并振荡,制成标准色阶:
b.称量0.10g制得的样品溶于水配成500mL溶液.再取5mL待测液,加入1mL M溶液,后加蒸馏水至10mL振荡,与标准色阶比较.
| 试管编号 | ① | ② | ③ | ④ | ⑤ |
| NaNO2含量/mg•L-1 | 0 | 20 | 40 | 60 | 80 |
(5)用目视比色法证明维生素C可以有效降低NaNO2的含量.设计并完成下列实验报告.
| 实验方案 | 实验现象 | 实验结论 |
| 取5mL 待测液,加入一定量的维生素C,振荡,再加入1mL M溶液,加入至蒸馏水10mL,再振荡, 与④号色阶对比. | 紫红色比④色阶浅 | 维生素C 可以有效降低NaNO2的含量. |
分析 (1)金属铜和稀硝酸制得的一氧化氮中含有水,会和过氧化钠发生反应产生氧气,氧气极易把一氧化氮氧化;
(2)高锰酸钾具有氧化性,能将一氧化氮氧化,根据电子守恒配平方程式即可;
(3)硝酸具有挥发性,会干扰实验结果,据此回答分析;
(4)根据物质纯度计算公式纯度=$\frac{物质含量}{样品含量}$×100%;
(5)根据维生素C的作用以及要和(4)中的甲同学的实验方案形成对比试验,进行实验设计.
解答 解:(1)金属铜和稀硝酸制得的一氧化氮中含有水,水会和过氧化钠发生反应产生氧气,2Na2O2+2H2O=4NaOH+O2↑,生成的氧气极易把一氧化氮氧化为二氧化氮,即2NO+O2=NO2,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;2NO+O2=2NO2;
(2)高锰酸钾具有氧化性,能将一氧化氮氧化,反应的实质是:5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O,
故答案为:5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O;
(3)由于获得一氧化氮所用的硝酸具有挥发性,这样会干扰实验结果,可以在A,、B之间增加装有水的洗气瓶,减小实验误差,
故答案为:在A、B之间增加装有水的洗气瓶;
(4)甲待测液颜色与④号色阶相同,则甲同学制得的样品中NaN02的纯度$\frac{60×1{0}^{-3}×100}{0.1g}$×100%=60%,
故答案为:60%;
(5)要和(4)中的甲同学的实验方案形成对比试验,同样可以是先取5mL待测液,然后加入维生素C,并加入1 mLM溶液,最后加入蒸馏水至10mL,若紫红色比③色阶浅,说明亚硝酸钠的含量低,则可以证明维生素C可以有效降低NaNO2的含量.
故答案为:维生素C;加入至蒸馏水10mL;紫红色比④色阶浅.
点评 本题是一道实验方案的设计和探究题,涉及反应原理分析,并熟练运用化学方程式或离子反应方程表示;对学生分析和解决问题的能力要求较高,综合性强,难度大.

| A. | AlCl3 | B. | Al(OH)3 | C. | Na2CO3 | D. | Al |
| A. | 氮气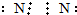 | B. | 氨基H:N:H | ||
| C. | 过氧化氢H+[:O:]2-H+ | D. | 氯化钠Na+[:Cl:]- |
| A. | CH4,NH3,H2O,Ne | B. | OH-,NH4+,H3O+,Ne | ||
| C. | H3O+,NH4+,Na+,HF | D. | OH-,F-,Mg2+,Na+ |
| A. | $\frac{1}{1}H$和$\frac{2}{1}H$互为同位素 | B. | 淀粉和纤维素互为同分异构体 | ||
| C. |  和 和 属于同一种物质 属于同一种物质 | D. | C2H6和C4H10互为同系物 |
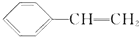 ,它一般不可能具有的性质是( )
,它一般不可能具有的性质是( )| A. | 易溶于水,不易溶于有机溶剂 | |
| B. | 在空气中燃烧产生黑烟 | |
| C. | 能使溴的四氯化碳溶液褪色 | |
| D. | 能发生加成反应在一定条件下可与4倍物质的量的氢气加成 |
| A. | 常温下,1L0.1mol•L-1CuSO4溶液中含有的Cu2+数目为0.1NA | |
| B. | 含1molCl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液NH4+为NA | |
| C. | 2mol SO2与足量氧气在适当的条件下反应生成SO3,转移的电子数为4NA | |
| D. | 25°C时,1L pH=1的硫酸溶液中,含有H+的数目为0.2NA |
 卤代烃是一类重要的有机合成中间体,是许多有机合成的原料.根据卤代烃的相关性质,回答下列问题
卤代烃是一类重要的有机合成中间体,是许多有机合成的原料.根据卤代烃的相关性质,回答下列问题