题目内容
17.下列说法中,不正确的是( )| A. | $\frac{1}{1}H$和$\frac{2}{1}H$互为同位素 | B. | 淀粉和纤维素互为同分异构体 | ||
| C. | 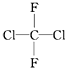 和 和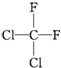 属于同一种物质 属于同一种物质 | D. | C2H6和C4H10互为同系物 |
分析 A、同种元素的不同种原子间互称同位素;
B、淀粉和纤维素的分子式不同;
C、分子式相同、结构也相同的物质为同一种物质;
D、结构相似,分子组成上相差一个或若干个CH2的化合物互为同系物.
解答 解:A、同种元素的不同种原子间互称同位素,故11H和21H同为H元素的两种H原子,故互为同位素,故A正确;
B、淀粉和纤维素的聚合度的范围不同,故两者的分子式不同,则不是同分异构体,故B错误;
C、分子式相同、结构也相同的物质为同一种物质,由于单键可以扭转,故 和
和 的分子式相同、结构也相同,故为同一种物质,故C正确;
的分子式相同、结构也相同,故为同一种物质,故C正确;
D、结构相似,分子组成上相差一个或若干个CH2的化合物互为同系物,C2H6和C4H10的结构相似,均为烷烃,且两者相差2个CH2,故互为同系物,故D正确.
故选B.
点评 本题考查了同位素、同分异构体、同系物和同一种物质等概念的辨析,难度不大,掌握概念是关键.

练习册系列答案
相关题目
17.在恒容的密闭容器中发生反应H2(g)+I2(g)?2HI(g),下列可以说明反应达到平衡状态的是( )
①单位时间内生成n mol I2的同时生成2n mol HI
②单位时间内生成n mol H2的同时生成2n mol I2
③混合气体的颜色不再改变
④混合气体的物质的量不再改变.
①单位时间内生成n mol I2的同时生成2n mol HI
②单位时间内生成n mol H2的同时生成2n mol I2
③混合气体的颜色不再改变
④混合气体的物质的量不再改变.
| A. | ①③ | B. | ②④ | C. | ①③④ | D. | ①②③④ |
12.亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,使用过量会使人中毒,国际上对食品中亚硝酸钠的用量控制在很低的水平上.某学习小组针对亚硝酸钠设计了如下实验:
实验Ⅰ制备NaNO2
该小组查阅资料知:2NO+Na2O2═2NaNO2;2NO2+Na2O2═2NaNO3
设计制备装置如下(夹持装置略去):
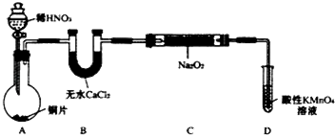
(1)如果没有B装置,C中发生的副反应有2Na2O2+2H2O=4NaOH+O2↑,2NO+O2=2NO2.
(2)装置D可将剩余的NO氧化成NO3-,发生反应的离子方程式为5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O.
(3)甲同学检查完装置气密性良好后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质.于是在A与B装置间增加了在A、B之间增加装有水的洗气瓶装置,改进后提高了NaNO2的纯度.
实验Ⅱ测定制取的样品中NaNO2的含量
步骤:a.在5个有编号的带刻度试管(比色管)中分别加入不同量的NaNO2溶液,各加入1mL的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为10mL并振荡,制成标准色阶:
b.称量0.10g制得的样品溶于水配成500mL溶液.再取5mL待测液,加入1mL M溶液,后加蒸馏水至10mL振荡,与标准色阶比较.
(4)步骤b中比较结果是:待测液颜色与④号色阶相同.则甲同学制得的样品中NaN02的质量分数是:60%.
(5)用目视比色法证明维生素C可以有效降低NaNO2的含量.设计并完成下列实验报告.
实验Ⅰ制备NaNO2
该小组查阅资料知:2NO+Na2O2═2NaNO2;2NO2+Na2O2═2NaNO3
设计制备装置如下(夹持装置略去):

(1)如果没有B装置,C中发生的副反应有2Na2O2+2H2O=4NaOH+O2↑,2NO+O2=2NO2.
(2)装置D可将剩余的NO氧化成NO3-,发生反应的离子方程式为5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O.
(3)甲同学检查完装置气密性良好后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质.于是在A与B装置间增加了在A、B之间增加装有水的洗气瓶装置,改进后提高了NaNO2的纯度.
实验Ⅱ测定制取的样品中NaNO2的含量
步骤:a.在5个有编号的带刻度试管(比色管)中分别加入不同量的NaNO2溶液,各加入1mL的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为10mL并振荡,制成标准色阶:
b.称量0.10g制得的样品溶于水配成500mL溶液.再取5mL待测液,加入1mL M溶液,后加蒸馏水至10mL振荡,与标准色阶比较.
| 试管编号 | ① | ② | ③ | ④ | ⑤ |
| NaNO2含量/mg•L-1 | 0 | 20 | 40 | 60 | 80 |
(5)用目视比色法证明维生素C可以有效降低NaNO2的含量.设计并完成下列实验报告.
| 实验方案 | 实验现象 | 实验结论 |
| 取5mL 待测液,加入一定量的维生素C,振荡,再加入1mL M溶液,加入至蒸馏水10mL,再振荡, 与④号色阶对比. | 紫红色比④色阶浅 | 维生素C 可以有效降低NaNO2的含量. |
2.短周期元素形成的两种简单离子X+、Y2-,下列有关说法正确的是( )
| A. | X、Y元素的主族序数之差为1 | |
| B. | 若X+、Y2-相差两个电子层,则X2Y可能是离子化合物也可能是共价化合物 | |
| C. | 若X+、Y2-核外电子数相差8,则原子半径Y>X | |
| D. | 若X+、Y2-具有相同的电子层结构,则离子半径X+>Y2- |
9.在一定条件下,对于密闭容器中进行的可逆反应:2SO2(g)+O2(g)?2SO3(g).下列说法不正确的是( )
| A. | 改变反应条件可以改变该反应的限度 | |
| B. | 达到平衡后,SO3、SO2、O2在密闭容器中共存 | |
| C. | 达到平衡后,反应停止,正、逆反应速率都等于零 | |
| D. | 为了提高SO2的转化率,应适当提高O2的浓度 |
6.某单烯烃与氢气的加成产物为:(CH3 )2CHCH2CH3,下列相关说法正确的是( )
| A. | 原单烯烃只可能有3种不同结构 | |
| B. | 该产物的名称是1,1-二甲基丙烷 | |
| C. | 1mol加成产物燃烧消耗6.5mol氧气 | |
| D. | 原烯烃与分子式是C3H6的烃一定互为同系物 |
7.从海水中可以提取溴,主要反应为2Br-+Cl2═Br2+2Cl-,下列说法中正确的是( )
| A. | 溴离子具有氧化性 | B. | 氯气是还原剂 | ||
| C. | 该反应属于取代反应 | D. | 氯气的氧化性比溴单质强 |
