题目内容
2.设NA表示阿伏加罗常数的值,下列说法正确的是( )| A. | 常温下,1L0.1mol•L-1CuSO4溶液中含有的Cu2+数目为0.1NA | |
| B. | 含1molCl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液NH4+为NA | |
| C. | 2mol SO2与足量氧气在适当的条件下反应生成SO3,转移的电子数为4NA | |
| D. | 25°C时,1L pH=1的硫酸溶液中,含有H+的数目为0.2NA |
分析 A、铜离子为弱碱阳离子,在溶液中会水解;
B、根据溶液的电中性来分析;
C、二氧化硫和氧气的反应为可逆反应,不能进行彻底;
D、pH=1的硫酸溶液中,氢离子浓度为0.1mol/L.
解答 解:A、铜离子为弱碱阳离子,在溶液中会水解,故溶液中的铜离子个数小于0.1NA个,故A错误;
B、根据溶液的电中性可知:n(Cl-)+n(OH-)=n(H+)+n(NH4+),而溶液显中性,故溶液中n(OH-)=n(H+),故有n(Cl-)=n(NH4+),即铵根离子为NA个,故B正确;
C、二氧化硫和氧气的反应为可逆反应,不能进行彻底,故2mol二氧化硫不能反应完全,则转移的电子数小于4NA个,故C错误;
D、pH=1的硫酸溶液中,氢离子浓度为0.1mol/L,故1L溶液中氢离子的个数为0.1NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案
相关题目
12.亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,使用过量会使人中毒,国际上对食品中亚硝酸钠的用量控制在很低的水平上.某学习小组针对亚硝酸钠设计了如下实验:
实验Ⅰ制备NaNO2
该小组查阅资料知:2NO+Na2O2═2NaNO2;2NO2+Na2O2═2NaNO3
设计制备装置如下(夹持装置略去):
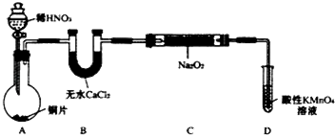
(1)如果没有B装置,C中发生的副反应有2Na2O2+2H2O=4NaOH+O2↑,2NO+O2=2NO2.
(2)装置D可将剩余的NO氧化成NO3-,发生反应的离子方程式为5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O.
(3)甲同学检查完装置气密性良好后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质.于是在A与B装置间增加了在A、B之间增加装有水的洗气瓶装置,改进后提高了NaNO2的纯度.
实验Ⅱ测定制取的样品中NaNO2的含量
步骤:a.在5个有编号的带刻度试管(比色管)中分别加入不同量的NaNO2溶液,各加入1mL的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为10mL并振荡,制成标准色阶:
b.称量0.10g制得的样品溶于水配成500mL溶液.再取5mL待测液,加入1mL M溶液,后加蒸馏水至10mL振荡,与标准色阶比较.
(4)步骤b中比较结果是:待测液颜色与④号色阶相同.则甲同学制得的样品中NaN02的质量分数是:60%.
(5)用目视比色法证明维生素C可以有效降低NaNO2的含量.设计并完成下列实验报告.
实验Ⅰ制备NaNO2
该小组查阅资料知:2NO+Na2O2═2NaNO2;2NO2+Na2O2═2NaNO3
设计制备装置如下(夹持装置略去):

(1)如果没有B装置,C中发生的副反应有2Na2O2+2H2O=4NaOH+O2↑,2NO+O2=2NO2.
(2)装置D可将剩余的NO氧化成NO3-,发生反应的离子方程式为5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O.
(3)甲同学检查完装置气密性良好后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质.于是在A与B装置间增加了在A、B之间增加装有水的洗气瓶装置,改进后提高了NaNO2的纯度.
实验Ⅱ测定制取的样品中NaNO2的含量
步骤:a.在5个有编号的带刻度试管(比色管)中分别加入不同量的NaNO2溶液,各加入1mL的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为10mL并振荡,制成标准色阶:
b.称量0.10g制得的样品溶于水配成500mL溶液.再取5mL待测液,加入1mL M溶液,后加蒸馏水至10mL振荡,与标准色阶比较.
| 试管编号 | ① | ② | ③ | ④ | ⑤ |
| NaNO2含量/mg•L-1 | 0 | 20 | 40 | 60 | 80 |
(5)用目视比色法证明维生素C可以有效降低NaNO2的含量.设计并完成下列实验报告.
| 实验方案 | 实验现象 | 实验结论 |
| 取5mL 待测液,加入一定量的维生素C,振荡,再加入1mL M溶液,加入至蒸馏水10mL,再振荡, 与④号色阶对比. | 紫红色比④色阶浅 | 维生素C 可以有效降低NaNO2的含量. |
13.在一恒温、恒容的密闭容器中发生反应A(s)+2B(g)?C(g)+D(g),能够表明该反应已达平衡状态的是( )
| A. | 物质C和D的浓度相等 | |
| B. | 混合气体的平均相对分子质量不再变化 | |
| C. | A的物质的量浓度不再变化 | |
| D. | 物质B,C,D的物质的量之比为2:1:1 |
7.从海水中可以提取溴,主要反应为2Br-+Cl2═Br2+2Cl-,下列说法中正确的是( )
| A. | 溴离子具有氧化性 | B. | 氯气是还原剂 | ||
| C. | 该反应属于取代反应 | D. | 氯气的氧化性比溴单质强 |
10.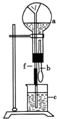 在图装置中,烧瓶中充满于燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶,则a和b分别是( )
在图装置中,烧瓶中充满于燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶,则a和b分别是( )
 在图装置中,烧瓶中充满于燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶,则a和b分别是( )
在图装置中,烧瓶中充满于燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶,则a和b分别是( )| a(干燥气体) | b(液体) | |
| A | NO2 | 水 |
| B | CO2 | 4mol/L NaOH溶液 |
| C | Cl2 | 饱和NaCl溶液 |
| D | NH3 | CCl4 |
| A. | A | B. | B | C. | C | D. | D |

 .
. .
.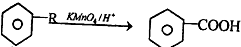
 是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).
是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选). ;反应③中被破坏的化学键属于非极性键(填“极性”或“非极性”).
;反应③中被破坏的化学键属于非极性键(填“极性”或“非极性”).