题目内容
15.表是周期表中的一部分,根据A-I在周期表中的位置,第(1)~(3)小题用元素符号或化学式回答,(4)~(6)小题按题目要求回答.| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)A分别与D、E、G、形成的化合物中,稳定性由弱到强的顺序:CH4<NH3<HF,
(3)F、H元素对应的最高价氧化物含氧酸由强到弱的顺序是:H3PO4<HClO4,
(4)A和E组成化合物比A和F组成化合物的沸点高(填“高”或“低”),原因是氨气分子间存在氢键
(5)用电子式表示B的最高价氧化物对应的水化物的形成过程

(6)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式Al2O3+2OH-═2AlO2-+H2O.
分析 由元素在周期表中位置,可知A为氢、B为Na、C为Al、D为C、E为N、F为P、G为F、H为Cl、I为Ne.
(1)上述元素中Na的金属性最强;
(2)非金属性越强,氢化物越稳定;
(3)非金属性越强,对应的最高价氧化物含氧酸酸性越强;
(4)氨气分子间含氢键,沸点高;
(5)NaOH为离子化合物;
(6)B的最高价氧化物的水化物为氢氧化钠,C的最高价氧化物为氧化铝,二者反应生成偏铝酸钠与水.
解答 解:由元素在周期表中位置,可知A为氢、B为Na、C为Al、D为C、E为N、F为P、G为F、H为Cl、I为Ne.
(1)金属性最强元素与水的方应的方程式为2Na+2H20=2NaOH+H2↑,故答案为:2Na+2H20=2NaOH+H2↑;
(2)A分别与D、E、G、形成的化合物中,稳定性由弱到强的顺序CH4<NH3<HF,故答案为:CH4<NH3<HF;
(3)F、H元素对应的最高价氧化物含氧酸由强到弱的顺序是H3PO4<HClO4,故答案为:H3PO4<HClO4;
(4)A和E组成化合物比A和F组成化合物的沸点高,因氨气分子间存在氢键,故答案为:高;氨气分子间存在氢键;
(5)电子式表示B的最高价氧化物对应的水化物的形成过程为 ,
,
故答案为: ;
;
(6)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式为Al2O3+2OH-═2AlO2-+H2O,故答案为:Al2O3+2OH-═2AlO2-+H2O.
点评 本题考查位置、结构与性质的综合应用,为高频考点,把握元素的位置、元素周期律、元素化合物知识为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
14.在一定温度下,可逆反应A2(g)+B2(g)═2AB(g)达到化学平衡的标志是 ( )
| A. | 容器内气体的总质量不随时间而变化 | |
| B. | 单位时间内有nmolA2生成的同时就有nmolB2生成 | |
| C. | 2 v(A2)正=v(AB)逆 | |
| D. | A2、B2(g)、AB(g)的浓度之比为1:1:2 |
3.如图所示是气体性质实验的常用装置,下列有关实验现象的说法不正确的是( )
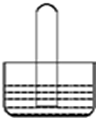

| A. | 若水槽中是水,试管中是NO2,可看到液面上升并且气体颜色逐渐变浅 | |
| B. | 若水槽中是NaOH溶液,试管中是Cl2,可看到液面上升、试管中黄绿色褪去 | |
| C. | 若水槽中是水并滴有几滴紫色石蕊,试管中是SO2,可看到液面上升并变为无色 | |
| D. | 若水槽中是水并滴有几滴酚酞,试管中是NH3,可看到液面上升并呈红色 |
10.下列反应的离子方程式正确的是( )
| A. | 氨气通入盐酸溶液 HCl+NH3═NH4Cl | |
| B. | 澄清的石灰水跟盐酸反应 H++OH-═H2O | |
| C. | 碳酸钡溶于醋酸 BaCO3+2H+═Ba2++H2O+CO2↑ | |
| D. | 金属钠跟水反应 Na+2H2O═Na++2OH-+H2↑ |
20.某密闭容器中,有下列反应发生:A(g)+3B(g)?2C(g)+D(g).若0-2min时间段内v(A)=1mol/(L•min),则此段时间v(C)为( )
| A. | 0.5 mol/(L•min) | B. | 1 mol/(L•min) | C. | 2 mol/(L•min) | D. | 3 mol/(L•min) |
4.下列有关功能高分子材料的用途的叙述中不正确的是( )
| A. | 高吸水性树脂可用于干旱地区抗旱保水、改良土壤、改造沙漠 | |
| B. | 离子交换树脂主要用于分离和提纯物质 | |
| C. | 医用高分子可用于制造医用器械和人造器官 | |
| D. | 聚乙炔膜可用于分离工业废水和海水的淡化 |
5.有如图所示的装置,当电流表中产生持续电流时,下列说法正确的是( )


| A. | 电子由Al沿导线流向Cu | |
| B. | 电流由Cu电极流出 | |
| C. | Cu是原电池的负极 | |
| D. | 铝片上的电极反应式为:Al-3e-═Al3+ |
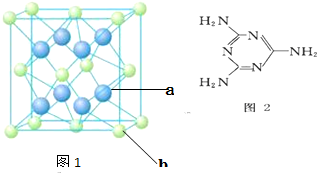 X、Y、Z、M、N、Q P为元素周期表前四周期的7种元素.其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1,Q在元素周期表的各元素中电负性最大.P元素的第三电子层处于全充满状态,第四电子层只有一个电子请回答下列问题:
X、Y、Z、M、N、Q P为元素周期表前四周期的7种元素.其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1,Q在元素周期表的各元素中电负性最大.P元素的第三电子层处于全充满状态,第四电子层只有一个电子请回答下列问题: ,P元素属于ds区元素.
,P元素属于ds区元素.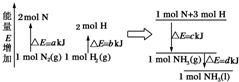 化学反应N2(g)+3H2(g)=2NH3(l)的能量变化如图所示,(注:图中△E都为正值),写出该反应的热化学方程式:N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ•mol-1.
化学反应N2(g)+3H2(g)=2NH3(l)的能量变化如图所示,(注:图中△E都为正值),写出该反应的热化学方程式:N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ•mol-1.