题目内容
4.下列有关功能高分子材料的用途的叙述中不正确的是( )| A. | 高吸水性树脂可用于干旱地区抗旱保水、改良土壤、改造沙漠 | |
| B. | 离子交换树脂主要用于分离和提纯物质 | |
| C. | 医用高分子可用于制造医用器械和人造器官 | |
| D. | 聚乙炔膜可用于分离工业废水和海水的淡化 |
分析 A.保水剂是一种强吸水树脂,能在短时间内吸收自身重量几百倍至上千倍的水分;
B.离子交换树脂是带有官能团(有交换离子的活性基团)、具有网状结构、不溶性的高分子化合物;
C.医用高分子材料是指用以制造人体内脏、体外器官、药物剂型及医疗器械的聚合物材料;
D.聚乙炔膜属于导电高分子.
解答 解:A.保水剂是一种强吸水树脂,能在短时间内吸收自身重量几百倍至上千倍的水分,高吸水性树脂可做保水剂,故A正确;
B.离子交换树脂是带有官能团(有交换离子的活性基团)、具有网状结构、不溶性的高分子化合物,主要用于分离和提纯物质,故B正确;
C.医用高分子材料是指用以制造人体内脏、体外器官、药物剂型及医疗器械的聚合物材料,可用于制造医用器械和人造器官,故C正确;
D.聚乙炔膜属于导电高分子,主要用于电子元件,故D错误.
故选D.
点评 本题考查有机物的结构与性质、用途,为高频考点,把握常见有机物的组成、官能团与性质的关系等为解答的关键,题目难度不大.

练习册系列答案
相关题目
3. 季戊四醇被大量用于涂料工业生产醇酸树脂、合成高级润滑剂、增塑剂、表面活性剂以及医药、炸药等,其结构简式如图所示.季戊四醇可由HCHO与CH3CHO两种有机物按一定比例加成得到的产物与H2再加成得到.则反应中HCHO与CH3CHO的物质的量之比为( )
季戊四醇被大量用于涂料工业生产醇酸树脂、合成高级润滑剂、增塑剂、表面活性剂以及医药、炸药等,其结构简式如图所示.季戊四醇可由HCHO与CH3CHO两种有机物按一定比例加成得到的产物与H2再加成得到.则反应中HCHO与CH3CHO的物质的量之比为( )
 季戊四醇被大量用于涂料工业生产醇酸树脂、合成高级润滑剂、增塑剂、表面活性剂以及医药、炸药等,其结构简式如图所示.季戊四醇可由HCHO与CH3CHO两种有机物按一定比例加成得到的产物与H2再加成得到.则反应中HCHO与CH3CHO的物质的量之比为( )
季戊四醇被大量用于涂料工业生产醇酸树脂、合成高级润滑剂、增塑剂、表面活性剂以及医药、炸药等,其结构简式如图所示.季戊四醇可由HCHO与CH3CHO两种有机物按一定比例加成得到的产物与H2再加成得到.则反应中HCHO与CH3CHO的物质的量之比为( )| A. | 1:1 | B. | 1:2 | C. | 3:1 | D. | 3:2 |
15.表是周期表中的一部分,根据A-I在周期表中的位置,第(1)~(3)小题用元素符号或化学式回答,(4)~(6)小题按题目要求回答.
(1)写出金属性最强元素与水的方应的方程式:2Na+2H20=2NaOH+H2↑.
(2)A分别与D、E、G、形成的化合物中,稳定性由弱到强的顺序:CH4<NH3<HF,
(3)F、H元素对应的最高价氧化物含氧酸由强到弱的顺序是:H3PO4<HClO4,
(4)A和E组成化合物比A和F组成化合物的沸点高(填“高”或“低”),原因是氨气分子间存在氢键
(5)用电子式表示B的最高价氧化物对应的水化物的形成过程
(6)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式Al2O3+2OH-═2AlO2-+H2O.
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)A分别与D、E、G、形成的化合物中,稳定性由弱到强的顺序:CH4<NH3<HF,
(3)F、H元素对应的最高价氧化物含氧酸由强到弱的顺序是:H3PO4<HClO4,
(4)A和E组成化合物比A和F组成化合物的沸点高(填“高”或“低”),原因是氨气分子间存在氢键
(5)用电子式表示B的最高价氧化物对应的水化物的形成过程

(6)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式Al2O3+2OH-═2AlO2-+H2O.
12.某原电池总反应的离子方程式是Zn+Cu2+═Zn2++Cu,该原电池的正确组成是( )
| A | B | C | D | |
| 正极 | Zn | Cu | Cu | Fe |
| 负极 | Cu | Zn | Zn | Zn |
| 电解质溶液 | CuCl2 | H2SO4 | AgNO3 | CuCl2 |
| A. | A | B. | B | C. | C | D. | D |
19.四种短周期元素在周期表中的相对位置如图所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.
请回答下列问题:
(1)元素Z位于周期表中第三周期,VA族;
(2)这些元素的氢化物中,水溶液碱性最强的是NH3(写化学式);
(3)Y的最高价氧化物的化学式为N2O5.
请回答下列问题:
| X | Y | |
| Z | W |
(2)这些元素的氢化物中,水溶液碱性最强的是NH3(写化学式);
(3)Y的最高价氧化物的化学式为N2O5.
9.已知X、Y、Z三种元素的为同一周期的元素,且它们的最高价氧化物对应的水化物酸性依次增强,则下列判断不正确的是( )
| A. | 原子半径按X、Y、Z的顺序增大 | B. | 原子序数按X、Y、Z顺序增大 | ||
| C. | 单质的氧化性按X、Y、Z顺序增强 | D. | 氢化物的稳定性按X、Y、Z顺序增强 |
16.表是元素周期表的一部分.
根据①~⑫元素在周期表中的位置,回答下列有关问题:(请用化学符号填写)
(1)写出下列元素符号:①N,⑥Si.
(2)在这些元素的最高价氧化物对应水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.(用化学式填写)
(3)在这些元素中单质的氧化性最强的是F2,还原性最强的是K.化学性质最不活泼的元素是Ar.(用化学式填写)
(4)画出原子结构示意图:⑪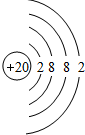 .
.
(5)用电子式表示⑦和⑩形成化合物的过程: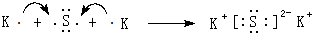 .
.
(6)⑦和⑧分别形成的气态氢化物的化学式是H2S、HCl.其中相对不稳定的是H2S.
(7)在③与④中,化学性质较活泼的是Na(填元素符号),在⑧与⑫中,化学性质较活泼的是Cl,(填元素符号)如何证明(用离子方程式表示):Cl2+2Br-═Br2+2Cl-.
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(1)写出下列元素符号:①N,⑥Si.
(2)在这些元素的最高价氧化物对应水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.(用化学式填写)
(3)在这些元素中单质的氧化性最强的是F2,还原性最强的是K.化学性质最不活泼的元素是Ar.(用化学式填写)
(4)画出原子结构示意图:⑪
 .
.(5)用电子式表示⑦和⑩形成化合物的过程:
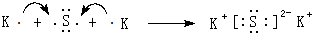 .
.(6)⑦和⑧分别形成的气态氢化物的化学式是H2S、HCl.其中相对不稳定的是H2S.
(7)在③与④中,化学性质较活泼的是Na(填元素符号),在⑧与⑫中,化学性质较活泼的是Cl,(填元素符号)如何证明(用离子方程式表示):Cl2+2Br-═Br2+2Cl-.
13.NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5NA | |
| B. | 28g乙烯所含共用电子对数目为5NA | |
| C. | 104克苯乙烯所含碳碳双键数为4NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
14.已知1-18号元素的离子aW3+、bX+、CY2-、dZ-都具有相同的电子层结构,则下列叙述或表示方法正确的是( )
| A. | 原子半径Y>Z>X>W | B. | 氢化物的稳定性H2Y>HZ | ||
| C. | 离子的氧化性aW3+>bX+ | D. | a+3<c-2 |