题目内容
6. X、Y、Z、M、N、Q P为元素周期表前四周期的7种元素.其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1,Q在元素周期表的各元素中电负性最大.P元素的第三电子层处于全充满状态,第四电子层只有一个电子请回答下列问题:
X、Y、Z、M、N、Q P为元素周期表前四周期的7种元素.其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1,Q在元素周期表的各元素中电负性最大.P元素的第三电子层处于全充满状态,第四电子层只有一个电子请回答下列问题:(1)X元素在周期表中的位置是第三周期ⅥA族,它的外围电子的电子排布图为
 ,P元素属于ds区元素.
,P元素属于ds区元素.(2)XZ2分子的空间构型是V形,YZ2分子中Y的杂化轨道类型为sp杂化,相同条件下两者在水中的溶解度较大的是SO2(写分子式),理由是SO2为极性分子,CO2为非极性分子,H2O为极性溶剂,极性分子易溶于极性溶剂,故SO2的溶解度较大.
(3)含有元素N的盐的焰色反应为紫 色,许多金属盐都可以发生焰色反应,其原是电子由较高能级跃迁到较低能级时,以光的形式释放能量
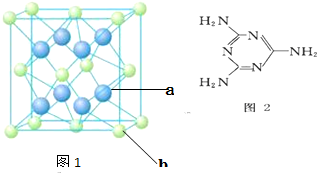
(4)元素M与元素Q形成晶体结构如图1所示,设其晶胞边长为a pm,该化合物的摩尔质量为Dg/mol.求该晶胞密度的计算式为$\frac{312×1{0}^{30}}{{a}^{3}{N}_{A}}$g/cm3
(5)三聚氰胺是一种含氮化合物,其结构简式如图2所示. 三聚氰胺分子中氮原子轨道杂化类型是sp2、sp3,1mol三聚氰胺分子中 σ键的数目为15NA.
分析 X、Y、Z、M、N、Q、P为元素周期表前四周期的7种元素,X原子核外的M层中只有两对成对电子,核外电子排布应为1s22s22p63s23p4,X为S元素;Y原子核外的L层电子数是K层的两倍,Y有2个电子层,最外层电子数为4,故Y为C元素;Z是地壳内含量最高的元素,为O元素;M的内层电子数是最外层电子数的9倍,M只能处于第四周期,最外层电子数只能为2,内层电子总数为18,核外电子总数为20,故M为Ca元素;N的原子序数比M小1,则N为K元素;Q在元素周期表的各元素中电负性最大,Q为F元素;P元素的第三电子层处于全充满状态,第四电子层只有一个电子,原子核外电子数=2+8+18+1=29,则P为Cu元素,据此解答.
解答 解:X、Y、Z、M、N、Q、P为元素周期表前四周期的7种元素,X原子核外的M层中只有两对成对电子,核外电子排布应为1s22s22p63s23p4,X为S元素;Y原子核外的L层电子数是K层的两倍,Y有2个电子层,最外层电子数为4,故Y为C元素;Z是地壳内含量最高的元素,为O元素;M的内层电子数是最外层电子数的9倍,M只能处于第四周期,最外层电子数只能为2,内层电子总数为18,核外电子总数为20,故M为Ca元素;N的原子序数比M小1,则N为K元素;Q在元素周期表的各元素中电负性最大,Q为F元素;P元素的第三电子层处于全充满状态,第四电子层只有一个电子,原子核外电子数=2+8+18+1=29,则P为Cu元素.
(1)X为S元素,处于周期表中第三周期ⅥA族,外围电子排布为3s23p4,它的外围电子的电子排布图为 ,P为Cu元素,价电子排布为3d104s1,属于ds区元素,
,P为Cu元素,价电子排布为3d104s1,属于ds区元素,
故答案为:第三周期ⅥA族; ;ds;
;ds;
(2)SO2分子中S原子价层电子对数=2+$\frac{6-2×2}{2}$=3,S原子含有1对孤电子对,故其立体结构是V形,
CO2分子C原子成2个σ键、没有孤电子对,C的杂化轨道类型为sp杂化,
SO2为极性分子,CO2为非极性分子,H2O为极性溶剂,极性分子易溶于极性溶剂,故SO2的溶解度较大,
故答案为:V形;sp杂化;SO2;SO2为极性分子,CO2为非极性分子,H2O为极性溶剂,极性分子易溶于极性溶剂,故SO2的溶解度较大;
(3)含有K元素的盐的焰色反应为紫色,许多金属盐都可以发生焰色反应,其原因是电子由较高能级跃迁到较低能级时,以光的形式释放能量,
故答案为:紫;电子由较高能级跃迁到较低能级时,以光的形式释放能量;
(4)元素Ca与元素F形成晶体化学式为CaF2,晶胞中绿色球数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、蓝色球为8个,则绿色球为Ca,蓝色球为F,故该化合物的摩尔质量为D g/mol,晶胞质量=4×$\frac{D}{{N}_{A}}$g,晶胞边长为a pm,则晶胞体积=(a×10-10 cm)3=a3××10-30 cm3,则晶胞密度=$\frac{4×\frac{D}{{N}_{A}}g}{{a}^{3}×1{0}^{-30}c{m}^{3}}$=$\frac{4×1{0}^{30}×D}{{a}^{3}×{N}_{A}}$g/cm3,
故答案为:$\frac{4×1{0}^{30}×D}{{a}^{3}×{N}_{A}}$;
(5)三聚氰胺分子中处于环上的N原子成2个σ键,有1对孤电子对,采取sp2杂化,氨基中N原子成3个σ键,含有1对孤电子对,N原子采取sp3杂化,单键为σ键,双键含有1个σ键、1个π键,故1个三聚氰胺分子含有15个σ键,则1mol三聚氰胺分子中σ键的数目为15NA,
故答案为:sp2、sp3;15NA.
点评 本题是对物质结构的考查,涉及核外电子的排布、分子结构与性质、晶胞计算等,(4)中注意利用均摊法计算晶胞的质量,难度中等.

| A. | Na2CO3 | B. | CH3OH | C. | Al2O3 | D. | Cu(OH)2 |
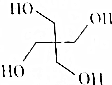 季戊四醇被大量用于涂料工业生产醇酸树脂、合成高级润滑剂、增塑剂、表面活性剂以及医药、炸药等,其结构简式如图所示.季戊四醇可由HCHO与CH3CHO两种有机物按一定比例加成得到的产物与H2再加成得到.则反应中HCHO与CH3CHO的物质的量之比为( )
季戊四醇被大量用于涂料工业生产醇酸树脂、合成高级润滑剂、增塑剂、表面活性剂以及医药、炸药等,其结构简式如图所示.季戊四醇可由HCHO与CH3CHO两种有机物按一定比例加成得到的产物与H2再加成得到.则反应中HCHO与CH3CHO的物质的量之比为( )| A. | 1:1 | B. | 1:2 | C. | 3:1 | D. | 3:2 |
| A. | C2H6 | B. | C3H4 | C. | C6H6 | D. | C2H4 |
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)A分别与D、E、G、形成的化合物中,稳定性由弱到强的顺序:CH4<NH3<HF,
(3)F、H元素对应的最高价氧化物含氧酸由强到弱的顺序是:H3PO4<HClO4,
(4)A和E组成化合物比A和F组成化合物的沸点高(填“高”或“低”),原因是氨气分子间存在氢键
(5)用电子式表示B的最高价氧化物对应的水化物的形成过程

(6)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式Al2O3+2OH-═2AlO2-+H2O.
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(1)写出下列元素符号:①N,⑥Si.
(2)在这些元素的最高价氧化物对应水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.(用化学式填写)
(3)在这些元素中单质的氧化性最强的是F2,还原性最强的是K.化学性质最不活泼的元素是Ar.(用化学式填写)
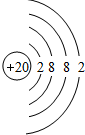
(4)画出原子结构示意图:⑪
 .
.(5)用电子式表示⑦和⑩形成化合物的过程:
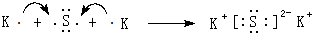 .
.(6)⑦和⑧分别形成的气态氢化物的化学式是H2S、HCl.其中相对不稳定的是H2S.
(7)在③与④中,化学性质较活泼的是Na(填元素符号),在⑧与⑫中,化学性质较活泼的是Cl,(填元素符号)如何证明(用离子方程式表示):Cl2+2Br-═Br2+2Cl-.