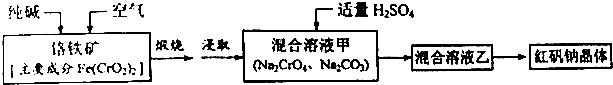
题目内容
20.某密闭容器中,有下列反应发生:A(g)+3B(g)?2C(g)+D(g).若0-2min时间段内v(A)=1mol/(L•min),则此段时间v(C)为( )| A. | 0.5 mol/(L•min) | B. | 1 mol/(L•min) | C. | 2 mol/(L•min) | D. | 3 mol/(L•min) |
分析 根据化学方程式的系数之比等于各物质的浓度变化量之比,进行分析求解.
解答 解:v(C)=2v(A)=2×1mol/(L•min)=2 mol/(L•min),故选C.
点评 本题考查学生化学反应速率的计算知识,注意化学方程式的系数之比等于各物质的浓度变化量之比这一结论的使用,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.A.B.C是周期表中相邻的三个元素,A和B是同周期,B和C同主族,三种元素最外层电子总数之和为17,核内质子数之和为31,则A.B.C三种元素是( )
| A. | Mg、Al、B | B. | Li、Be、Mg | C. | N、O、S | D. | O、F、C |
15.表是周期表中的一部分,根据A-I在周期表中的位置,第(1)~(3)小题用元素符号或化学式回答,(4)~(6)小题按题目要求回答.
(1)写出金属性最强元素与水的方应的方程式:2Na+2H20=2NaOH+H2↑.
(2)A分别与D、E、G、形成的化合物中,稳定性由弱到强的顺序:CH4<NH3<HF,
(3)F、H元素对应的最高价氧化物含氧酸由强到弱的顺序是:H3PO4<HClO4,
(4)A和E组成化合物比A和F组成化合物的沸点高(填“高”或“低”),原因是氨气分子间存在氢键
(5)用电子式表示B的最高价氧化物对应的水化物的形成过程
(6)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式Al2O3+2OH-═2AlO2-+H2O.
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)A分别与D、E、G、形成的化合物中,稳定性由弱到强的顺序:CH4<NH3<HF,
(3)F、H元素对应的最高价氧化物含氧酸由强到弱的顺序是:H3PO4<HClO4,
(4)A和E组成化合物比A和F组成化合物的沸点高(填“高”或“低”),原因是氨气分子间存在氢键
(5)用电子式表示B的最高价氧化物对应的水化物的形成过程

(6)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式Al2O3+2OH-═2AlO2-+H2O.
5.以下自发进行反应可用能量判据来解释的是( )
| A. | 硝酸铵自发地溶于水 | |
| B. | 2N2O5(g)═4NO2(g)+O2(g)△H=+56.7kJ•mol-1 | |
| C. | (NH4 )2 CO3(s)═NH4HCO3(s)+NH3(g);△H=+74.9 kJ/mol | |
| D. | 2H2(g)+O2(g)═2H2O(l);△H=-571.6 KJ/mol |
12.某原电池总反应的离子方程式是Zn+Cu2+═Zn2++Cu,该原电池的正确组成是( )
| A | B | C | D | |
| 正极 | Zn | Cu | Cu | Fe |
| 负极 | Cu | Zn | Zn | Zn |
| 电解质溶液 | CuCl2 | H2SO4 | AgNO3 | CuCl2 |
| A. | A | B. | B | C. | C | D. | D |
9.已知X、Y、Z三种元素的为同一周期的元素,且它们的最高价氧化物对应的水化物酸性依次增强,则下列判断不正确的是( )
| A. | 原子半径按X、Y、Z的顺序增大 | B. | 原子序数按X、Y、Z顺序增大 | ||
| C. | 单质的氧化性按X、Y、Z顺序增强 | D. | 氢化物的稳定性按X、Y、Z顺序增强 |
10.为提纯下列物质(括号内为杂质).所选试剂及方法均正确的是( )
| 选项 | 物质(括号内为杂质) | 除杂试剂 | 方法 |
| A | 溴苯(溴) | CCl4 | 分液 |
| B | 硝基苯(HNO3) | NaOH | 分液 |
| C | 乙烷(乙烯) | 氢气 | 洗气 |
| D | 乙醇(乙酸) | NaOH | 分液 |
| A. | A | B. | B | C. | C | D. | D |
 甲醇(CH3OH)是一种优质燃料,
甲醇(CH3OH)是一种优质燃料,