题目内容
5.有如图所示的装置,当电流表中产生持续电流时,下列说法正确的是( )
| A. | 电子由Al沿导线流向Cu | |
| B. | 电流由Cu电极流出 | |
| C. | Cu是原电池的负极 | |
| D. | 铝片上的电极反应式为:Al-3e-═Al3+ |
分析 铜、铝、浓硝酸构成的原电池中,金属铝遇到浓硝酸会发生钝化,所以金属铜是负极,金属铝是正极,负极上金属失电子发生氧化反应,正极上是得电子的还原反应.
解答 解:A、电子从负极流向正极,即从铜流向铝,故A错误;
B、以金属铜是负极,金属铝是正极,故B错误;
C、铜、铝、浓硝酸构成的原电池中,金属铝遇到浓硝酸会发生钝化,所以金属铜是负极,金属铝是正极,故C正确;
D、铝是正极,该电极上金属不会反应,是硝酸中的硝酸根离子发生得电子的还原反应,故D错误.
故选C.
点评 本题考查学生原电池的构成条件以及工作原理的应用知识,注意金属铝常温下遇到浓硝酸会发生钝化的知识是关键,难度中等.

练习册系列答案
相关题目
15.表是周期表中的一部分,根据A-I在周期表中的位置,第(1)~(3)小题用元素符号或化学式回答,(4)~(6)小题按题目要求回答.
(1)写出金属性最强元素与水的方应的方程式:2Na+2H20=2NaOH+H2↑.
(2)A分别与D、E、G、形成的化合物中,稳定性由弱到强的顺序:CH4<NH3<HF,
(3)F、H元素对应的最高价氧化物含氧酸由强到弱的顺序是:H3PO4<HClO4,
(4)A和E组成化合物比A和F组成化合物的沸点高(填“高”或“低”),原因是氨气分子间存在氢键
(5)用电子式表示B的最高价氧化物对应的水化物的形成过程
(6)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式Al2O3+2OH-═2AlO2-+H2O.
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)A分别与D、E、G、形成的化合物中,稳定性由弱到强的顺序:CH4<NH3<HF,
(3)F、H元素对应的最高价氧化物含氧酸由强到弱的顺序是:H3PO4<HClO4,
(4)A和E组成化合物比A和F组成化合物的沸点高(填“高”或“低”),原因是氨气分子间存在氢键
(5)用电子式表示B的最高价氧化物对应的水化物的形成过程

(6)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式Al2O3+2OH-═2AlO2-+H2O.
16.表是元素周期表的一部分.
根据①~⑫元素在周期表中的位置,回答下列有关问题:(请用化学符号填写)
(1)写出下列元素符号:①N,⑥Si.
(2)在这些元素的最高价氧化物对应水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.(用化学式填写)
(3)在这些元素中单质的氧化性最强的是F2,还原性最强的是K.化学性质最不活泼的元素是Ar.(用化学式填写)
(4)画出原子结构示意图:⑪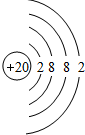 .
.
(5)用电子式表示⑦和⑩形成化合物的过程: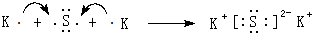 .
.
(6)⑦和⑧分别形成的气态氢化物的化学式是H2S、HCl.其中相对不稳定的是H2S.
(7)在③与④中,化学性质较活泼的是Na(填元素符号),在⑧与⑫中,化学性质较活泼的是Cl,(填元素符号)如何证明(用离子方程式表示):Cl2+2Br-═Br2+2Cl-.
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(1)写出下列元素符号:①N,⑥Si.
(2)在这些元素的最高价氧化物对应水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.(用化学式填写)
(3)在这些元素中单质的氧化性最强的是F2,还原性最强的是K.化学性质最不活泼的元素是Ar.(用化学式填写)
(4)画出原子结构示意图:⑪
 .
.(5)用电子式表示⑦和⑩形成化合物的过程:
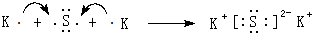 .
.(6)⑦和⑧分别形成的气态氢化物的化学式是H2S、HCl.其中相对不稳定的是H2S.
(7)在③与④中,化学性质较活泼的是Na(填元素符号),在⑧与⑫中,化学性质较活泼的是Cl,(填元素符号)如何证明(用离子方程式表示):Cl2+2Br-═Br2+2Cl-.
13.NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5NA | |
| B. | 28g乙烯所含共用电子对数目为5NA | |
| C. | 104克苯乙烯所含碳碳双键数为4NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
20.下列关于反应能量的说法正确的是( )
| A. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则1 mol NaOH的氢氧化钠固体与含0.5 mol H2SO4的稀硫酸混合后放出57.3 kJ的热量 | |
| B. | 相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol 氢分子所具有的能量为E2,则2E1=E2 | |
| C. | 101 kPa时,2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,则反应物总能量>生成物总能量 |
10.为提纯下列物质(括号内为杂质).所选试剂及方法均正确的是( )
| 选项 | 物质(括号内为杂质) | 除杂试剂 | 方法 |
| A | 溴苯(溴) | CCl4 | 分液 |
| B | 硝基苯(HNO3) | NaOH | 分液 |
| C | 乙烷(乙烯) | 氢气 | 洗气 |
| D | 乙醇(乙酸) | NaOH | 分液 |
| A. | A | B. | B | C. | C | D. | D |
17.下列有关硅及其化合物的叙述中,错误的是( )
| A. | 单质硅是良好的半导体材料 | B. | 硅常温时可以和强碱反应 | ||
| C. | 二氧化硅广泛存在于自然界 | D. | 硅酸是挥发性酸 |
14.已知1-18号元素的离子aW3+、bX+、CY2-、dZ-都具有相同的电子层结构,则下列叙述或表示方法正确的是( )
| A. | 原子半径Y>Z>X>W | B. | 氢化物的稳定性H2Y>HZ | ||
| C. | 离子的氧化性aW3+>bX+ | D. | a+3<c-2 |