题目内容
 (1)现有以下几种物质::①晶体二氧化硅②干冰③五氯化磷④金刚石⑤过氧化钠⑥冰⑦碳化硅⑧白磷;请用编号填写:通过非极性键形成原子晶体的是
(1)现有以下几种物质::①晶体二氧化硅②干冰③五氯化磷④金刚石⑤过氧化钠⑥冰⑦碳化硅⑧白磷;请用编号填写:通过非极性键形成原子晶体的是(2)含氧酸可表示为:(HO)mROn酸的强度与酸中的非羟基氧原子数n有关,n越大,酸性越强.一般n=0弱酸,n=1中强酸,n=2强酸,n=3超强酸.据实验事实可知硼酸(H3BO3)是一元弱酸,而亚磷酸是中强酸(H3PO3)
①写出硼酸(H3BO3)的电离方程式
②写出亚磷酸与过量的NaOH反应的化学方程式
(3)有①HF②NH3③NH2-④H2S四种微粒,它们与H2O分子互为等电子体的是
(4)在相同条件下,SO2在水中的溶解度和CO2在水中的溶解度相比,SO2的溶解度大,从分子性质的角度阐述的理由是
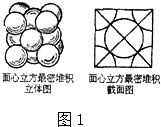
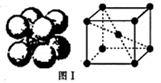
(5)金单质的晶体是面心立方体,如图1所示立方体每个面5个Au原子紧密堆砌(即面心立方体最紧密堆积),若Au原子的半径为dcm,Au原子的相对原子质量为M.则Au单质晶体的密度为
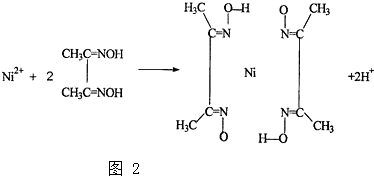
(6)实验室检验Ni2+可用丁二酮肟与之作用生成腥红色配合物沉淀.请在此配合物中图2用化学键和氢键标出未画出的作用力(镍的配位数为4).
考点:晶胞的计算,配合物的成键情况,“等电子原理”的应用,弱电解质在水溶液中的电离平衡
专题:化学键与晶体结构
分析:(1)同种非金属原子间形成非极性键,根据晶体构成微粒分析;根据常见晶体的空间结构分析;
(2)①硼酸为一元弱酸,在水溶液里部分电离出阴阳离子;
②亚磷酸是中强酸含有2个羟基,属于二元酸;
(3)等电子体是指具有原子总数相同、价电子总数相同的微粒;
(4)水是极性分子,根据相似相溶原理判断;
(5)已知Au原子的半径为dcm,Au原子的相对原子质量为M,根据ρ=
计算密度;
(6)Ni2+含有空轨道,N原子含有孤对电子对,N原子与Ni2+形成配位键,氧原子与氢原子之间形成氢键.
(2)①硼酸为一元弱酸,在水溶液里部分电离出阴阳离子;
②亚磷酸是中强酸含有2个羟基,属于二元酸;
(3)等电子体是指具有原子总数相同、价电子总数相同的微粒;
(4)水是极性分子,根据相似相溶原理判断;
(5)已知Au原子的半径为dcm,Au原子的相对原子质量为M,根据ρ=
| m |
| V |
(6)Ni2+含有空轨道,N原子含有孤对电子对,N原子与Ni2+形成配位键,氧原子与氢原子之间形成氢键.
解答:
解:(1)同种非金属原子间形成非极性键,金刚石中碳原子与碳原子之间以非极性键结合,形成的空间网状晶体属于原子晶体;白磷属于分子晶体,白磷分子为正四面体结构;
故答案为:④;⑧;
(2)①硼酸为一元弱酸,在水溶液里部分电离出阴阳离子,其电离方程式为:H3BO3+H2O?[B(OH)4]-+H+,
故答案为:H3BO3+H2O?[B(OH)4]-+H+;
②亚磷酸是中强酸含有2个羟基,属于二元酸,则1molH3PO3可以消耗2molNaOH,所以亚磷酸与过量的NaOH反应的化学方程式为:H2PO3+2NaOH=Na2HPO3+2H2O;
故答案为:H2PO3+2NaOH=Na2HPO3+2H2O;
(3)等电子体是指具有原子总数相同、价电子总数相同的微粒,H2O中含有3个原子和8个价电子,则与水互为等电子体的是NH2-④H2S;
故答案为:③④;
(4)SO2中S原子的价层电子对为
=3,VSEPR模型为平面三角形,S原子1对孤对电子对,分子为V形,结构不对称,属于极性分子,CO2是非极性分子,水是极性分子,根据相似相溶原理,极性分子易溶于极性溶剂,则SO2在水中的溶解度比CO2的大.
故答案为:H2O和SO2是极性分子,CO2是非极性分子,根据相似原理SO2在水中的溶解度比CO2的大;
(5)金元素单质晶体是面心立方体,该晶胞中金原子个数=8×
+6×
=4,金原子半径为d cm,原子的直径为2dcm,晶胞的边长=
dcm,所以晶胞的体积为16
d3cm3
,
ρ=
=
=
g?cm-3,
故答案为:
;
(6)Ni2+含有空轨道,N原子含有孤对电子对,N原子与Ni2+形成配位键,不同分子中氧原子与氢原子之间形成氢键,如图所示: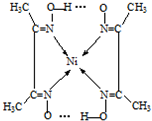 ,故答案为:
,故答案为: .
.
故答案为:④;⑧;
(2)①硼酸为一元弱酸,在水溶液里部分电离出阴阳离子,其电离方程式为:H3BO3+H2O?[B(OH)4]-+H+,
故答案为:H3BO3+H2O?[B(OH)4]-+H+;
②亚磷酸是中强酸含有2个羟基,属于二元酸,则1molH3PO3可以消耗2molNaOH,所以亚磷酸与过量的NaOH反应的化学方程式为:H2PO3+2NaOH=Na2HPO3+2H2O;
故答案为:H2PO3+2NaOH=Na2HPO3+2H2O;
(3)等电子体是指具有原子总数相同、价电子总数相同的微粒,H2O中含有3个原子和8个价电子,则与水互为等电子体的是NH2-④H2S;
故答案为:③④;
(4)SO2中S原子的价层电子对为
| 6 |
| 2 |
故答案为:H2O和SO2是极性分子,CO2是非极性分子,根据相似原理SO2在水中的溶解度比CO2的大;
(5)金元素单质晶体是面心立方体,该晶胞中金原子个数=8×
| 1 |
| 8 |
| 1 |
| 2 |
| 8 |
| 2 |
,
ρ=
| m |
| V |
| ||
16
|
| ||
| 8d3NA |
故答案为:
| ||
| 8d3NA |
(6)Ni2+含有空轨道,N原子含有孤对电子对,N原子与Ni2+形成配位键,不同分子中氧原子与氢原子之间形成氢键,如图所示:
 ,故答案为:
,故答案为: .
.
点评:本题考查了化学键、分子的空间构型、含氧酸、等电子体、杂化轨道理论及其应用、配位键、晶胞的计算等,题目考查的知识点较多,综合性较强,侧重于考查学生对所学知识的综合运用能力,题目难度中等.

练习册系列答案
相关题目
下列水解离子方程式正确的是( )
| A、NH4++H2O?NH3?H2O+H+ |
| B、HCO3-+H2O?H3O++CO32- |
| C、CO32-+2H2O?H2CO3+2OH- |
| D、Fe3++3H2O?Fe(OH)3↓+3H+ |
 现有8种元素,它们的原子序数依次增大,其中A、B、C、D、E为短周期主族元素,F、G、H为第四周期元素.请根据下列相关信息,回答问题.
现有8种元素,它们的原子序数依次增大,其中A、B、C、D、E为短周期主族元素,F、G、H为第四周期元素.请根据下列相关信息,回答问题.
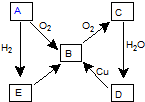 图表示某气态单质A及其化合物之间的转化关系 (某些产物和反应条件已略去).
图表示某气态单质A及其化合物之间的转化关系 (某些产物和反应条件已略去).