题目内容
SO2是重要的化工原料,某学习小组利用下图装置探究SO2与Na2O2的反应.
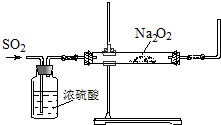
(1)甲同学设计了该实验装置.乙同学认为它有不合理的地方,请指出: .
(2)反应完毕后,大家认为硬质玻璃管中的固体成分有多种可能:
假设Ⅰ:全部为Na2SO3;
假设Ⅱ:为Na2SO3和Na2O2的混合物;
假设Ⅲ: ;
假设Ⅳ:为Na2SO3 和Na2SO4的混合物;
假设Ⅴ:为Na2O2和Na2SO4的混合物.
假设Ⅲ、Ⅳ、Ⅴ的共同理由是 .
(3)现有下列实验用品:几支试管、带胶塞的导管(单孔)、滴管、药匙、品红溶液、蒸馏水、Ba(NO3)2溶液、BaCl2溶液、稀硫酸、稀盐酸、稀硝酸,请你从中选出合适的用品对“假设Ⅳ”进行验证,完成下表(可以不填满):

(1)甲同学设计了该实验装置.乙同学认为它有不合理的地方,请指出:
(2)反应完毕后,大家认为硬质玻璃管中的固体成分有多种可能:
假设Ⅰ:全部为Na2SO3;
假设Ⅱ:为Na2SO3和Na2O2的混合物;
假设Ⅲ:
假设Ⅳ:为Na2SO3 和Na2SO4的混合物;
假设Ⅴ:为Na2O2和Na2SO4的混合物.
假设Ⅲ、Ⅳ、Ⅴ的共同理由是
(3)现有下列实验用品:几支试管、带胶塞的导管(单孔)、滴管、药匙、品红溶液、蒸馏水、Ba(NO3)2溶液、BaCl2溶液、稀硫酸、稀盐酸、稀硝酸,请你从中选出合适的用品对“假设Ⅳ”进行验证,完成下表(可以不填满):
| 实验步骤编号 | 实验操作 | 预期现象和结论 |
| ① | 待硬质玻管冷却到室温后,用药匙取少量白色固体于试管中. | / |
| ② | 向①的试管中加入 | |
| ③ | ||
| ④ |
考点:性质实验方案的设计
专题:实验设计题
分析:(1)二氧化硫有毒,多余的气体不能直接排放到空气中,应该添加没有尾气吸收装置;
(2)类比二氧化碳与过氧化钠的反应推测,过氧化钠与二氧化硫反应可能生成亚硫酸钠,过氧化钠和氧气具有氧化性,反应产物可能为硫酸钠,据此完成假设;
(3)假设Ⅳ反应后的固体为Na2SO3 和Na2SO4的混合物,分别根据具有亚硫酸钠、硫酸钠的方法设计方案,然后选取合适的试剂进行解答.
(2)类比二氧化碳与过氧化钠的反应推测,过氧化钠与二氧化硫反应可能生成亚硫酸钠,过氧化钠和氧气具有氧化性,反应产物可能为硫酸钠,据此完成假设;
(3)假设Ⅳ反应后的固体为Na2SO3 和Na2SO4的混合物,分别根据具有亚硫酸钠、硫酸钠的方法设计方案,然后选取合适的试剂进行解答.
解答:
解:(1)二氧化硫是一种有毒的气体,不能直接将多余的二氧化碳排放到空气中,否则会造成空气污染,所以该装置中不合理之处为:没有尾气的处理装置,
故答案为:没有尾气的处理装置;
(2)根据CO2与Na2O2的反应可知,SO2与Na2O2反应可能生成Na2SO3,则提出的假设有:假设Ⅰ:全部为Na2SO3,假设Ⅱ:为Na2SO3和Na2O2的混合物;由于Na2O2和反应产物的O2都具有氧化性,则反应后的固体可能为Na2SO,则可能的假设为:假设Ⅲ:全部为Na2SO4 ,假设Ⅳ:为Na2SO3 和Na2SO4的混合物,假设Ⅴ:为Na2O2和Na2SO4的混合物,
故答案为:全部为Na2SO4 ; Na2O2和新产生的O2有强氧化性,能将Na2SO3氧化为Na2SO4 ;
(3)假设Ⅳ:反应后的固体为Na2SO3 和Na2SO4的混合物,需要分别检验亚硫酸钠和硫酸钠,检验亚硫酸钠时,可以通过混合物与稀盐酸反应是否生成使品红溶液褪色的二氧化硫气体完成;检验硫酸钠,可以通过检验是否有不溶于盐酸的硫酸钡白色沉淀生成,检验步骤与现象为:
①待硬质玻管冷却到室温后,用药匙取少量白色固体于试管中,
②向①的试管中加入过量的稀盐酸,塞紧带导管的胶塞,并将导管通入装少量品红溶液的试管,若品红褪色说明生成的二氧化硫,则固体中含有Na2SO3,若品红不褪色则没有生成二氧化硫,固体中不含有Na2SO3;
③取②充分反应后的溶液于试管中,滴入适量BaCl2溶液,若有白色沉淀生成则固体中含有Na2SO4 ,若没有白色沉淀生成则固体中不含有Na2SO4,
故答案为:
.
故答案为:没有尾气的处理装置;
(2)根据CO2与Na2O2的反应可知,SO2与Na2O2反应可能生成Na2SO3,则提出的假设有:假设Ⅰ:全部为Na2SO3,假设Ⅱ:为Na2SO3和Na2O2的混合物;由于Na2O2和反应产物的O2都具有氧化性,则反应后的固体可能为Na2SO,则可能的假设为:假设Ⅲ:全部为Na2SO4 ,假设Ⅳ:为Na2SO3 和Na2SO4的混合物,假设Ⅴ:为Na2O2和Na2SO4的混合物,
故答案为:全部为Na2SO4 ; Na2O2和新产生的O2有强氧化性,能将Na2SO3氧化为Na2SO4 ;
(3)假设Ⅳ:反应后的固体为Na2SO3 和Na2SO4的混合物,需要分别检验亚硫酸钠和硫酸钠,检验亚硫酸钠时,可以通过混合物与稀盐酸反应是否生成使品红溶液褪色的二氧化硫气体完成;检验硫酸钠,可以通过检验是否有不溶于盐酸的硫酸钡白色沉淀生成,检验步骤与现象为:
①待硬质玻管冷却到室温后,用药匙取少量白色固体于试管中,
②向①的试管中加入过量的稀盐酸,塞紧带导管的胶塞,并将导管通入装少量品红溶液的试管,若品红褪色说明生成的二氧化硫,则固体中含有Na2SO3,若品红不褪色则没有生成二氧化硫,固体中不含有Na2SO3;
③取②充分反应后的溶液于试管中,滴入适量BaCl2溶液,若有白色沉淀生成则固体中含有Na2SO4 ,若没有白色沉淀生成则固体中不含有Na2SO4,
故答案为:
| 实验步骤编号 | 实验操作 | 预期现象和结论 |
| ① | ||
| ② | 过量的稀盐酸; 通入装少量品红溶液的试管 | 若品红褪色则固体中含有Na2SO3,若品红不褪色则固体中不含有Na2SO3; |
| ③ | 取②充分反应后的溶液于试管中,滴入适量BaCl2溶液 | 若有白色沉淀生成则固体中含有Na2SO4 ,若没有白色沉淀生成则固体中不含有Na2SO4; |
点评:本题考查了性质实验方案的设计、常见物质的检验,题目难度中等,注意掌握常见物质的性质及检验方法,明确物质性质实验方案设计与评价的方法,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
相关题目
 (1)现有以下几种物质::①晶体二氧化硅②干冰③五氯化磷④金刚石⑤过氧化钠⑥冰⑦碳化硅⑧白磷;请用编号填写:通过非极性键形成原子晶体的是
(1)现有以下几种物质::①晶体二氧化硅②干冰③五氯化磷④金刚石⑤过氧化钠⑥冰⑦碳化硅⑧白磷;请用编号填写:通过非极性键形成原子晶体的是
 钙的化合物在共农业生产和生活中有广泛的应用.
钙的化合物在共农业生产和生活中有广泛的应用.