题目内容
已知:①M可由烃R(C4H8)与HCl在一定条件下加成而得;②金属A能在B中燃烧,B能引起温室效应;③C能使石蕊试液变红,其相对分子质量比D大28.
有关M有如下转化关系,该转化有助于减少B气体的排放量.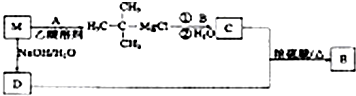
(1)A与B反应方程式为 .
(2)R的结构简式为 .
(3)写出D与C反应生成E的化学方程式 .
有关M有如下转化关系,该转化有助于减少B气体的排放量.
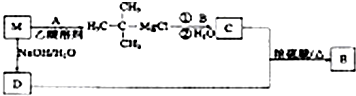
(1)A与B反应方程式为
(2)R的结构简式为
(3)写出D与C反应生成E的化学方程式
考点:有机物的推断
专题:有机物的化学性质及推断
分析:金属A能在B中燃烧,B能引起温室效应,则A为Mg,B为CO2.M可由烃R(C4H8)与HCl在一定条件下加成而得,则M为卤代烃,由M转化(CH3)3CMgCl可知R为CH2=C(CH3)2,M为(CH3)3CCl,M在氢氧化钠水溶液、加热条件下发生水解反应生成D为(CH3)3COH,C能使石蕊试液变红,则C含有羧基,其相对分子质量比D大28,则C为(CH3)3CCOOH,C与D发生酯化反应生成E为(CH3)3CCOOC(CH3)3,据此解答.
解答:
解:金属A能在B中燃烧,B能引起温室效应,则A为Mg,B为CO2.M可由烃R(C4H8)与HCl在一定条件下加成而得,则M为卤代烃,由M转化(CH3)3CMgCl可知R为CH2=C(CH3)2,M为(CH3)3CCl,M在氢氧化钠水溶液、加热条件下发生水解反应生成D为(CH3)3COH,C能使石蕊试液变红,则C含有羧基,其相对分子质量比D大28,则C为(CH3)3CCOOH,C与D发生酯化反应生成E为(CH3)3CCOOC(CH3)3,
(1)A与B反应方程式为:2Mg+CO2
2MgO+C,故答案为:2Mg+CO2
2MgO+C;
(2)由上述分析可知,R的结构简式为:CH2=C(CH3)2,故答案为:CH2=C(CH3)2;
(3)D与C反应生成E的化学方程式为:(CH3)3COH,+(CH3)3CCOOH
(CH3)3CCOOC(CH3)3+H2O,故答案为:(CH3)3COH,+(CH3)3CCOOH
(CH3)3CCOOC(CH3)3+H2O.
(1)A与B反应方程式为:2Mg+CO2
| ||
| ||
(2)由上述分析可知,R的结构简式为:CH2=C(CH3)2,故答案为:CH2=C(CH3)2;
(3)D与C反应生成E的化学方程式为:(CH3)3COH,+(CH3)3CCOOH
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
点评:本题考查有机物推断,注意根据有机物的结构进行推断,侧重考查学生分析推理与知识迁移应用,难度中等.

练习册系列答案
相关题目
设NA为阿伏加德罗常数,下列说法正确的是( )
| A、2.4g金属镁变成镁离子时失去的电子数目为0.1NA |
| B、2g氢气所含分子数目为2NA |
| C、在标准状况下,以任意比混合的氦气和氧气混合物22.4L,所含分子数为NA |
| D、在25℃、101kPa时,11.2L氮气所含的原子数目为NA |
德国人弗里茨?哈伯(Fritz Haber)由于发明了合成氨的方法而获得1918年诺贝尔化学奖,他的发明大大提高了农作物的产量同时也提高了硝酸、炸药的产量.下列说法中正确的是( )
| A、N2和H2在点燃或光照条件下可合成氨 |
| B、氨是共价化合物,硝酸是离子化合物 |
| C、氨气遇到浓硝酸会发生反应产生白烟 |
| D、由氨制取硝酸过程中,氮元素被还原 |
可逆反应2A(g)+3B(g)?2C(g);△H=-QkJ?mol-1(Q>0).现有甲、乙两个容积相同且不变的真空密闭容器,向甲容器中加入2molA和3molB,在一定条件下达到平衡时放出热量为Q1kJ;在相同的条件下,向乙容器中加入2molC达到平衡后吸收热量为Q2 kJ;已知2Q1=Q2.下列叙述正确的( )
| A、平衡时甲、乙中C的体积分数甲>乙 |
| B、平衡时甲中A的转化率为60% |
| C、达到平衡后,再向乙中加入0.8molA+1.2molB+1.2molC,平衡向生成A的正向移动 |
| D、D甲容器达到平衡后,升温,反应的平衡常数增大 |
下列说法不正确的是( )
| A、在干冰晶体中,与一个CO2分子相邻且等距离的CO2分子共有12个 |
| B、在SiO2晶体中,若含有1molSi原子,则Si-O键数为4NA |
| C、在金刚石晶体中,一个碳原子被12个六元碳环所共用,一个C-C键最多可形成6个六元环,一个六元环实际拥有一个碳原子 |
| D、mg石墨中,正六边形数目为m NA/24,每个环拥有碳原子数与C-C键数之比为2:3 |
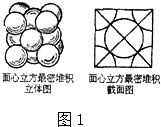 (1)现有以下几种物质::①晶体二氧化硅②干冰③五氯化磷④金刚石⑤过氧化钠⑥冰⑦碳化硅⑧白磷;请用编号填写:通过非极性键形成原子晶体的是
(1)现有以下几种物质::①晶体二氧化硅②干冰③五氯化磷④金刚石⑤过氧化钠⑥冰⑦碳化硅⑧白磷;请用编号填写:通过非极性键形成原子晶体的是
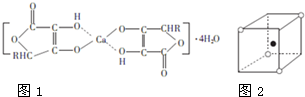 钙的化合物在共农业生产和生活中有广泛的应用.
钙的化合物在共农业生产和生活中有广泛的应用.