题目内容
已知CO(g)、H2(g)和CH3OH(l)的燃烧热(△H)分别为-283.0kJ?mol-1、-285.8kJ?mol-1和-726.5kJ?mol-1,则由CO(g)和H2(g)反应生成1molCH3OH(l)的△H 为( )
| A、-128.1 kJ?mol-1 |
| B、-411.1 kJ?mol-1 |
| C、-157.7 kJ?mol-1 |
| D、+157.7 kJ?mol-1 |
考点:用盖斯定律进行有关反应热的计算
专题:
分析:燃烧热化学方程式分别为:①CH3OH(l)+
O2(g)=CO2(g)+2H2O(l);△=-726.5KL/mol;
②CO(g)+
O2(g)=CO2(g)△H=-283KJ/mol;
③H2(g)+
O2(g)=H2O(l)△H=-285.5KJ/mol;
依据盖斯定律③×2+②-①计算即可.
| 3 |
| 2 |
②CO(g)+
| 1 |
| 2 |
③H2(g)+
| 1 |
| 2 |
依据盖斯定律③×2+②-①计算即可.
解答:
解:依据题干写出物质的燃烧热化学方程式:①CH3OH(l)+
O2(g)=CO2(g)+2H2O(l);△=-726.5KL/mol;
②CO(g)+
O2(g)=CO2(g)△H=-283KJ/mol;
③H2(g)+
O2(g)=H2O(l)△H=-285.5KJ/mol;
依据盖斯定律③×2+②-①得到:CO(g)+2H2(g)=CH3OH(l)△H=-128.1KJ/mol;
故选:A.
| 3 |
| 2 |
②CO(g)+
| 1 |
| 2 |
③H2(g)+
| 1 |
| 2 |
依据盖斯定律③×2+②-①得到:CO(g)+2H2(g)=CH3OH(l)△H=-128.1KJ/mol;
故选:A.
点评:本题考查了燃烧热的概念分析应用,盖斯定律的计算应用,理解燃烧热概念是解题关键,题目难度中等.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
已知X、Y、Z、W、R五种元素,原子序数依次增大,且原子序数都小于20,X元素的原子是所有元素的原子中半径最小的,Y、W同主族,Z、W同周期,Y元素原子的最外层电子数是次外层的3倍,Z、R分别是同周期中金属性最强的元素.下列说法不正确的是( )
| A、沸点:X2Y>X2W |
| B、由X、Y、Z、W四种元素组成的化合物既含有共价键又含离子键 |
| C、原子半径:X<Y<Z<W<R |
| D、Y与W形成的化合物WY2是形成酸雨的主要物质之一 |
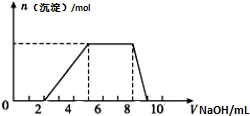 某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、AlO2-.当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )
某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、AlO2-.当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )| A、原溶液中一定含有的阳离子是H+、Mg2+、Al3+、NH4+ |
| B、反应最后形成的溶液中的溶质含AlCl3 |
| C、原溶液中Al3+与NH4+的物质的量之比1:3 |
| D、原溶液中含有的阴离子是AlO2-、Cl- |
下列各组离子在指定环境中一定能大量共存的是( )
| A、在含有大量I-离子的溶液中:Cl-、Fe3+、Na+、Mg2+ |
| B、在由水电离出的c(H+)=10-12mol?L-1 的溶液中:Na+、Ba2+、Cl-、Br- |
| C、使甲基橙呈红色的溶液中:Fe2+、Na+、SO42-、ClO- |
| D、在加入Al能放出大量H2的溶液中:NH4+、SO42-、Cl-、NO3- |
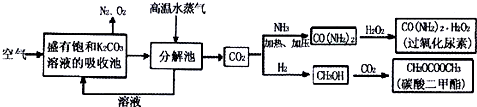
 工业上测量SO2、N2、O2混合气体中SO2含量的装置如图.反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O═H2SO4+2HI
工业上测量SO2、N2、O2混合气体中SO2含量的装置如图.反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O═H2SO4+2HI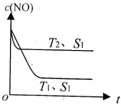 (1)汽车内燃机工作时发生反应:N2(g)+O2(g)?2NO(g),是导致汽车尾气中含有NO的原因之一.T℃时,向5L密闭容器中充入6.5molN2和7.5molO2,在5min时反应达到平衡状态,此时容器中NO的物质的量是5mol.
(1)汽车内燃机工作时发生反应:N2(g)+O2(g)?2NO(g),是导致汽车尾气中含有NO的原因之一.T℃时,向5L密闭容器中充入6.5molN2和7.5molO2,在5min时反应达到平衡状态,此时容器中NO的物质的量是5mol.