题目内容
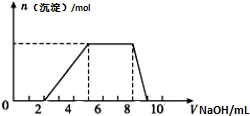 某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、AlO2-.当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )
某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、AlO2-.当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )| A、原溶液中一定含有的阳离子是H+、Mg2+、Al3+、NH4+ |
| B、反应最后形成的溶液中的溶质含AlCl3 |
| C、原溶液中Al3+与NH4+的物质的量之比1:3 |
| D、原溶液中含有的阴离子是AlO2-、Cl- |
考点:离子方程式的有关计算
专题:
分析:向溶液中滴加NaOH溶液时先没有沉淀生成,说明溶液中含有H+,溶液呈酸性,则溶液中不存在AlO2-,当H+完全反应后继续滴加NaOH溶液,有沉淀生成,当沉淀最大时继续滴加NaOH溶液,沉淀的物质的量不变,说明NaOH和NH4+反应,则溶液中一定含有NH4+,当NH4+完全反应后继续滴加NaOH溶液,沉淀逐渐减小最终消失,说明溶液中含有Al3+,不含Mg2+,最终溶液中溶质为NaCl、NH3.H2O和NaAlO2,据此分析解答.
解答:
解:向溶液中滴加NaOH溶液时先没有沉淀生成,说明溶液中含有H+,溶液呈酸性,则溶液中不存在AlO2-,当H+完全反应后继续滴加NaOH溶液,有沉淀生成,当沉淀最大时继续滴加NaOH溶液,沉淀的物质的量不变,说明NaOH和NH4+反应,则溶液中一定含有NH4+,当NH4+完全反应后继续滴加NaOH溶液,沉淀逐渐减小最终消失,说明溶液中含有Al3+,不含Mg2+,最终溶液中溶质为NaCl、NH3.H2O和NaAlO2,
A.通过以上分析知,原溶液中一定含有的阳离子有H+、Al3+、NH4+,故A错误;
B.通过以上分析知,最终得到的溶液中溶质为NaCl、NH3.H2O和NaAlO2,故B错误;
C.根据图象知,Al3+、NH4+消耗NaOH的物质的量之比为3:3,根据Al3++3OH-=Al(OH)3↓、NH4++OH-=NH3.H2O知,原溶液中Al3+与NH4+的物质的量之比1:3,故C正确;
D.通过以上分析知,原来溶液呈酸性,则一定不存在弱酸根离子AlO2-,故D错误;
故选C.
A.通过以上分析知,原溶液中一定含有的阳离子有H+、Al3+、NH4+,故A错误;
B.通过以上分析知,最终得到的溶液中溶质为NaCl、NH3.H2O和NaAlO2,故B错误;
C.根据图象知,Al3+、NH4+消耗NaOH的物质的量之比为3:3,根据Al3++3OH-=Al(OH)3↓、NH4++OH-=NH3.H2O知,原溶液中Al3+与NH4+的物质的量之比1:3,故C正确;
D.通过以上分析知,原来溶液呈酸性,则一定不存在弱酸根离子AlO2-,故D错误;
故选C.
点评:本题考查离子共存、离子之间的反应等知识点,侧重考查学生分析问题、解答问题能力,明确图象中曲线变化趋势、拐点的含义是解本题关键,知道曲线各个部分发生的化学反应,会根据原子守恒确定最终溶液中的溶质,题目难度中等.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
下列说法正确的是( )
| A、加入Ba(NO3)2溶液生成白色沉淀,加入稀盐酸后沉淀不消失,则原溶液中一定含有SO42- |
| B、通入氯气后,溶液变黄色,加入淀粉溶液后变蓝,则原溶液中一定有I- |
| C、加入碳酸钠溶液有白色沉淀生成,再加入盐酸,沉淀消失,则原溶液中一定含有Ba2+ |
| D、加入氢氧化钠溶液并加热,产生能使湿润的蓝色石蕊试纸变红的气体,则原溶液中一定有NH4+ |
用惰性电极电解下列各稀溶液,经一段时间后,溶液的pH保持不变的是( )
| A、CuCl2 |
| B、NaCl溶液 |
| C、H2SO4溶液 |
| D、K2SO4溶液 |
已知CO(g)、H2(g)和CH3OH(l)的燃烧热(△H)分别为-283.0kJ?mol-1、-285.8kJ?mol-1和-726.5kJ?mol-1,则由CO(g)和H2(g)反应生成1molCH3OH(l)的△H 为( )
| A、-128.1 kJ?mol-1 |
| B、-411.1 kJ?mol-1 |
| C、-157.7 kJ?mol-1 |
| D、+157.7 kJ?mol-1 |
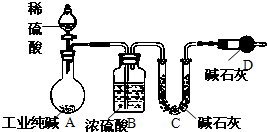 工业纯碱中常常含有NaCl、Na2SO4等杂质.为测定某工业纯碱的纯度,设计了如图实验装置.依据实验设计,请回答:
工业纯碱中常常含有NaCl、Na2SO4等杂质.为测定某工业纯碱的纯度,设计了如图实验装置.依据实验设计,请回答: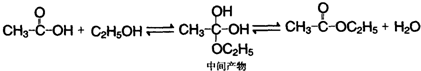
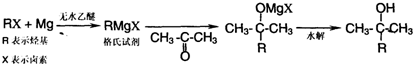
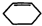 )为原料,通过以下各步转化,最终可制得有机物
)为原料,通过以下各步转化,最终可制得有机物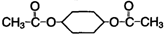 (部分反应过程及反应条件略去)
(部分反应过程及反应条件略去)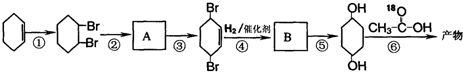
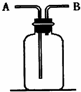 根据正放在桌面上的如图装置,回答下列问题:
根据正放在桌面上的如图装置,回答下列问题: