题目内容
一碳化学是指以研究分子中只含有一个碳原子的化合物(如CH4、CO2、CH3OH等)为原料来合成一系列化工原料和燃料的化学.科学家提出一种“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为其它化工原料,如图所示:
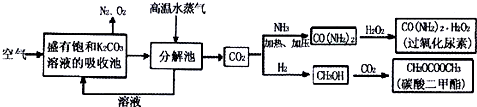
(1)分解池通入高温水蒸气的作用是 .
(2)目前工业上可用CO2生产 甲醇燃料,反应的化学方程式为:CO2(g)+3H2?CH3OH(g)+H2O(g)△H.
已知:
①该反应的平衡常数的表达式K= .
②该反应△H= KJ?mol-1
③用甲醇可以设计成燃料电池,应用于电脑、汽车等能量的来源.设计较多的是由甲醇负极、氧正极和质子交换膜构成,写出负极的电极反应式 .
④已知25℃℃、101kPa下,2.0g液态甲醇完全燃烧生成液态水时放出45.4KJ的热量,则甲醇的标准燃烧热为 KJ?mol-1.
⑤为了提高甲醇的日生产量,可采取的措施是 .
A.减小压强 B.使用合适的催化剂 C.温度越低越好 D.控制适当的温度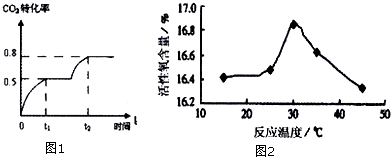
(3)CO2(g)+2CH4(OH)(g)?CH3OCOOCH3(g)+H2O(g)△H,控制一定条件,该反应能自发进行,即△H 0(填写>、<、=).在恒温容积可变的容器中加入1 mol CO2、2 molCH3OH.CO2的转化率与反应时间关系如图1示.在反应过程中加压,若t1时容器体积为1000mL,则 t2时容器体积V= mL.
(4)过氧化尿素合成反应式如下:CO(NH2)2+H2O2→CO(NH2)2?H2O2△H<0.当n(过氧化氢):n(尿素)为1.3:1,反应时间45min,用水杨酸作为稳定剂,分别考察反应温度对反应效果的影响如图2示[活性氧含量可视为CO(NH2)2?H2O2产量的直观表示].从图2可以看出,在实验选定的温度范围内,随反应温度的升高,产品活性氧含量先增加而随后减少.
①根据图2信息,最佳反应温度为 .
②如何说明该反应中在实验选定的温度范围内,随反应温度的升高,产品活性氧含量先增加而随后减少 .

(1)分解池通入高温水蒸气的作用是
(2)目前工业上可用CO2生产
已知:
| 共价键 | C=O | H-H | C-O | C-H | O-H |
| 键能KJ?mol-1 | 750 | 436 | 358 | 413 | 463 |
②该反应△H=
③用甲醇可以设计成燃料电池,应用于电脑、汽车等能量的来源.设计较多的是由甲醇负极、氧正极和质子交换膜构成,写出负极的电极反应式
④已知25℃℃、101kPa下,2.0g液态甲醇完全燃烧生成液态水时放出45.4KJ的热量,则甲醇的标准燃烧热为
⑤为了提高甲醇的日生产量,可采取的措施是
A.减小压强 B.使用合适的催化剂 C.温度越低越好 D.控制适当的温度

(3)CO2(g)+2CH4(OH)(g)?CH3OCOOCH3(g)+H2O(g)△H,控制一定条件,该反应能自发进行,即△H
(4)过氧化尿素合成反应式如下:CO(NH2)2+H2O2→CO(NH2)2?H2O2△H<0.当n(过氧化氢):n(尿素)为1.3:1,反应时间45min,用水杨酸作为稳定剂,分别考察反应温度对反应效果的影响如图2示[活性氧含量可视为CO(NH2)2?H2O2产量的直观表示].从图2可以看出,在实验选定的温度范围内,随反应温度的升高,产品活性氧含量先增加而随后减少.
①根据图2信息,最佳反应温度为
②如何说明该反应中在实验选定的温度范围内,随反应温度的升高,产品活性氧含量先增加而随后减少
考点:化学平衡的计算,原电池和电解池的工作原理
专题:
分析:(1)根据反应条件高温结合产物来分析;
(2)①根据平衡常数等于生成物浓度的幂次方之积比上反应物浓度的幂次方之积来书写;
②根据△H=反应物的键能之和-生成物的键能之和来计算;
③在燃料电池的负极上是燃料发生失电子发生氧化反应,据此来书写;
④燃烧热是指在25℃、101kPa下,1mol纯净物完全燃烧生成稳定的氧化物放出的热量,表示燃烧热的热化学方程式中可燃物的物质的量必须为1mol,产物必须为稳定氧化物;
⑤A.减小压强平衡向逆反应方向移动,降低甲醇的日生产量;
B.使用合适的催化剂,可以提供反应速率,从而提高甲醇的日生产量;
C、D.温度越低,虽然平衡向正反应方向移动,但反应速率较慢也不行,所以应控制适当的温度;
(3)根据△G=△H-T△S<0反应自发来判断;根据不同体积平衡时的K不变来计算;
(4)①根据图象分析,产品活性氧含量最高时温度最佳来分析;
②从反应速率及其平衡移动来分析温度对产品活性氧含量的影响;
(2)①根据平衡常数等于生成物浓度的幂次方之积比上反应物浓度的幂次方之积来书写;
②根据△H=反应物的键能之和-生成物的键能之和来计算;
③在燃料电池的负极上是燃料发生失电子发生氧化反应,据此来书写;
④燃烧热是指在25℃、101kPa下,1mol纯净物完全燃烧生成稳定的氧化物放出的热量,表示燃烧热的热化学方程式中可燃物的物质的量必须为1mol,产物必须为稳定氧化物;
⑤A.减小压强平衡向逆反应方向移动,降低甲醇的日生产量;
B.使用合适的催化剂,可以提供反应速率,从而提高甲醇的日生产量;
C、D.温度越低,虽然平衡向正反应方向移动,但反应速率较慢也不行,所以应控制适当的温度;
(3)根据△G=△H-T△S<0反应自发来判断;根据不同体积平衡时的K不变来计算;
(4)①根据图象分析,产品活性氧含量最高时温度最佳来分析;
②从反应速率及其平衡移动来分析温度对产品活性氧含量的影响;
解答:
解:(1)通入高温水蒸气后生成了二氧化碳,所以通入高温水蒸气的作用是使KHCO3分解放出二氧化碳气体,故答案为:使KHCO3分解放出二氧化碳气体;
(2)①平衡常数K=
,故答案为:
;
②△H=反应物的键能之和-生成物的键能之和=750×2+436×3-(413×3+358+463+463×2)=-178KJ/mol,故答案为:-178;
③在燃料电池的负极上是燃料发生失电子发生氧化反应,由甲醇负极、氧正极和质子交换膜构成得知是酸性溶液,所以负极的电极反应式为:CH3OH-6e-+H2O=CO2+6H+,故答案为:CH3OH-6e-+H2O=CO2+6H+;
④在25℃、101kPa下,2g液态甲醇完全燃烧生成液态水时放出45.4KJ的热量,则32g液态甲醇完全燃烧生成液态水时放出的热量为16×45.4KJ=726.4KJ,
甲醇的标准燃烧热为-726.4KJ?mol-1,故答案为:-726.4;
⑤A.减小压强平衡向逆反应方向移动,降低甲醇的日生产量,故A不选;
B.使用合适的催化剂,可以提供反应速率,从而提高甲醇的日生产量,故B选;
C、D.温度越低,虽然平衡向正反应方向移动,但反应速率较慢也不行,所以应控制适当的温度,故C不选,D选;
故选:BD;
(3)根据△G=△H-T△S<0反应自发,又该反应△S<0,控制一定条件,该反应能自发进行,即△H<0;
由图象数据可得:CO2(g)+2CH4(OH)(g)?CH3OCOOCH3(g)+H2O(g)
t1平衡0.5 1 0.5 0.5
t2平衡0.2 0.4 0.8 0.8
根据K相等,设t2时容器体积为V,则
=
,解得V=25ml,故答案为:<;25;
(4)①根据图象分析,产品活性氧含量最高时温度最佳,所以最佳温度为30℃,故答案为:30℃;
②首先温度升高有利于尿素溶解及加快了反应速率,进而提高产品收率,但是温度过高,又会导致过氧化氢受热分解,同时该反应又是放热反应,升高温度使平衡向逆反应方向移动,影响了产品活性氧含量,所以随反应温度的升高,产品活性氧含量先增加而随后减少,故答案为:由于温度升高有利于尿素溶解及加快了反应速率,进而提高产品收率,但是温度过高,又会导致过氧化氢受热分解,同时该反应又是放热反应,升高温度使平衡向逆反应方向移动,影响了产品活性氧含量;
(2)①平衡常数K=
| C(CH3OH)C(H 2O) |
| C(CO 2)C(H2) 3 |
| C(CH3OH)C(H 2O) |
| C(CO 2)C(H2) 3 |
②△H=反应物的键能之和-生成物的键能之和=750×2+436×3-(413×3+358+463+463×2)=-178KJ/mol,故答案为:-178;
③在燃料电池的负极上是燃料发生失电子发生氧化反应,由甲醇负极、氧正极和质子交换膜构成得知是酸性溶液,所以负极的电极反应式为:CH3OH-6e-+H2O=CO2+6H+,故答案为:CH3OH-6e-+H2O=CO2+6H+;
④在25℃、101kPa下,2g液态甲醇完全燃烧生成液态水时放出45.4KJ的热量,则32g液态甲醇完全燃烧生成液态水时放出的热量为16×45.4KJ=726.4KJ,
甲醇的标准燃烧热为-726.4KJ?mol-1,故答案为:-726.4;
⑤A.减小压强平衡向逆反应方向移动,降低甲醇的日生产量,故A不选;
B.使用合适的催化剂,可以提供反应速率,从而提高甲醇的日生产量,故B选;
C、D.温度越低,虽然平衡向正反应方向移动,但反应速率较慢也不行,所以应控制适当的温度,故C不选,D选;
故选:BD;
(3)根据△G=△H-T△S<0反应自发,又该反应△S<0,控制一定条件,该反应能自发进行,即△H<0;
由图象数据可得:CO2(g)+2CH4(OH)(g)?CH3OCOOCH3(g)+H2O(g)
t1平衡0.5 1 0.5 0.5
t2平衡0.2 0.4 0.8 0.8
根据K相等,设t2时容器体积为V,则
| ||||
|
| ||||
|
(4)①根据图象分析,产品活性氧含量最高时温度最佳,所以最佳温度为30℃,故答案为:30℃;
②首先温度升高有利于尿素溶解及加快了反应速率,进而提高产品收率,但是温度过高,又会导致过氧化氢受热分解,同时该反应又是放热反应,升高温度使平衡向逆反应方向移动,影响了产品活性氧含量,所以随反应温度的升高,产品活性氧含量先增加而随后减少,故答案为:由于温度升高有利于尿素溶解及加快了反应速率,进而提高产品收率,但是温度过高,又会导致过氧化氢受热分解,同时该反应又是放热反应,升高温度使平衡向逆反应方向移动,影响了产品活性氧含量;
点评:本题考查平衡常数的表达式及其计算、化学平衡影响因素、反应热的计算、电极反应式的书写等,要能根据题目所给信息解题,善于发掘题目信息,题目难度中等.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
已知CO(g)、H2(g)和CH3OH(l)的燃烧热(△H)分别为-283.0kJ?mol-1、-285.8kJ?mol-1和-726.5kJ?mol-1,则由CO(g)和H2(g)反应生成1molCH3OH(l)的△H 为( )
| A、-128.1 kJ?mol-1 |
| B、-411.1 kJ?mol-1 |
| C、-157.7 kJ?mol-1 |
| D、+157.7 kJ?mol-1 |


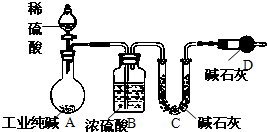 工业纯碱中常常含有NaCl、Na2SO4等杂质.为测定某工业纯碱的纯度,设计了如图实验装置.依据实验设计,请回答:
工业纯碱中常常含有NaCl、Na2SO4等杂质.为测定某工业纯碱的纯度,设计了如图实验装置.依据实验设计,请回答: