题目内容
 工业上测量SO2、N2、O2混合气体中SO2含量的装置如图.反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O═H2SO4+2HI
工业上测量SO2、N2、O2混合气体中SO2含量的装置如图.反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O═H2SO4+2HI(1)混合气体进入反应管后,量气管内增加的水的体积等于
(2)反应管内溶液蓝色消失后,没有及时停止通气.则测得的SO2含量
(3)反应管内的碘的淀粉溶液也可以用
(4)若碘溶液体积为Va mL,浓度为c mol?L-1,N2与O2的体积为Vb mL(已折算成标准状况下的体积).用Va、c mol?L-1、Vb表示SO2的体积百分含量为:
(5)将上述装置改为简易实验装置,除导管外,还需选用的仪器为
a.烧杯 b.试管 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞.
考点:探究物质的组成或测量物质的含量,物质的量浓度的相关计算
专题:实验探究和数据处理题
分析:(1)SO2、N2、O2混合气体进入反应管,SO2被吸收,气体体积的膨胀值为量气管内增加的水的体积,等于N2和O2的体积;
(2)反应管内溶液蓝色消失时,SO2与反应管内所含的I2恰好反应,若没及时停止通气,则未反应的SO2气体也排水到量气管,使N2、O2体积增加,测得SO2的含量降低;
(3)碘的淀粉溶液的作用是当其中的I2完全被SO2还原时,溶液的颜色是由蓝色变无色来指示终点的,所以其它可与SO2气体反应的物质,在达到终点有颜色改变时便可代替碘的淀粉溶液,如KMnO4溶液、溴水等;
(4)根据反应:SO2+I2+2H2O═H2SO4+2HI,V(SO2)=Vm×n(I2)=Vac×10-3mol×22400 mL?mol-1=22.4Va?c mL,据此计算解答;
(5)根据实验原理来选择合适的实验装置.
(2)反应管内溶液蓝色消失时,SO2与反应管内所含的I2恰好反应,若没及时停止通气,则未反应的SO2气体也排水到量气管,使N2、O2体积增加,测得SO2的含量降低;
(3)碘的淀粉溶液的作用是当其中的I2完全被SO2还原时,溶液的颜色是由蓝色变无色来指示终点的,所以其它可与SO2气体反应的物质,在达到终点有颜色改变时便可代替碘的淀粉溶液,如KMnO4溶液、溴水等;
(4)根据反应:SO2+I2+2H2O═H2SO4+2HI,V(SO2)=Vm×n(I2)=Vac×10-3mol×22400 mL?mol-1=22.4Va?c mL,据此计算解答;
(5)根据实验原理来选择合适的实验装置.
解答:
解:(1)混合气体进入反应管中,其中SO2与I2发生反应:SO2+I2+2H2O=H2SO4+2HI不产生气体,剩余的气体仅有N2和O2,量气管内增加的水的体积等于N2和O2的总体积,
故答案为:N2、O2;
(2)根据反应:SO2+I2+2H2O═H2SO4+2HI可求出吸收的SO2的体积:V(SO2)=Vm×n(I2),SO2的体积百分含量φ(SO2)=
式中V(SO2)的量是由n(I2)的物质的量决定的,而“没有及时停止通气”就会使得V(混合气体)增大,则φ(SO2)偏低,
故答案为:偏低;
(3)反应管内的碘的淀粉溶液可以用能吸收SO2的有色溶液代替,中学常见且可用的是溴水(或溴的四氯化碳溶液)或高锰酸钾酸性溶液,因为紫红色高锰酸钾的溶液通入二氧化硫时会发生5SO2+2H2O+KMnO4═K2SO4+2H2SO4+2MnSO4(无色溶液)的反应,溶液现象由紫红色变成无色,溴水(或溴的四氯化碳溶液)发生SO2+Br2+2H2O═H2SO4+2HBr,变成无色,所以也可采用高锰酸钾溶液代替碘的淀粉溶液完成该实验,
故答案为:酸性高锰酸钾溶液或溴水;
(4)由所给反应知SO2气体的物质的量等于碘的物质的量Va×10-3L×c mol?L-1=Vac×10-3mol,其体积为V(SO2)=Vac×10-3mol×22400 mL?mol-1=22.4Va?c mL,所以SO2的体积百分含量为:22.4Va?cmL÷[22.4c (Va mL+Vb mL)]×100%=
×100%,即SO2的百分含量为
×100%,
故答案为:
×100%;
(5)将上述装置改为简易实验装置,除导管外,还需选用的仪器试管、广口瓶、量筒、双孔塞,或是试管、量筒、双孔塞,
故答案为:bceg或beg.
故答案为:N2、O2;
(2)根据反应:SO2+I2+2H2O═H2SO4+2HI可求出吸收的SO2的体积:V(SO2)=Vm×n(I2),SO2的体积百分含量φ(SO2)=
| V(SO2) |
| V(混合气体) |
故答案为:偏低;
(3)反应管内的碘的淀粉溶液可以用能吸收SO2的有色溶液代替,中学常见且可用的是溴水(或溴的四氯化碳溶液)或高锰酸钾酸性溶液,因为紫红色高锰酸钾的溶液通入二氧化硫时会发生5SO2+2H2O+KMnO4═K2SO4+2H2SO4+2MnSO4(无色溶液)的反应,溶液现象由紫红色变成无色,溴水(或溴的四氯化碳溶液)发生SO2+Br2+2H2O═H2SO4+2HBr,变成无色,所以也可采用高锰酸钾溶液代替碘的淀粉溶液完成该实验,
故答案为:酸性高锰酸钾溶液或溴水;
(4)由所给反应知SO2气体的物质的量等于碘的物质的量Va×10-3L×c mol?L-1=Vac×10-3mol,其体积为V(SO2)=Vac×10-3mol×22400 mL?mol-1=22.4Va?c mL,所以SO2的体积百分含量为:22.4Va?cmL÷[22.4c (Va mL+Vb mL)]×100%=
| 22.4cVa |
| 22.4c(Va +Vb) |
| 22.4cVa |
| 22.4c(Va +Vb) |
故答案为:
| 22.4cVa |
| 22.4c(Va +Vb) |
(5)将上述装置改为简易实验装置,除导管外,还需选用的仪器试管、广口瓶、量筒、双孔塞,或是试管、量筒、双孔塞,
故答案为:bceg或beg.
点评:本题考查的是二氧化硫的性质、含量的测定,以及指示剂的选择,为高频考点,侧重于学生的分析、实验和计算能力的考查,难点在于(2)SO2含量误差分析和(4)SO2的百分含量计算,题目难度中等.

练习册系列答案
相关题目
已知CO(g)、H2(g)和CH3OH(l)的燃烧热(△H)分别为-283.0kJ?mol-1、-285.8kJ?mol-1和-726.5kJ?mol-1,则由CO(g)和H2(g)反应生成1molCH3OH(l)的△H 为( )
| A、-128.1 kJ?mol-1 |
| B、-411.1 kJ?mol-1 |
| C、-157.7 kJ?mol-1 |
| D、+157.7 kJ?mol-1 |
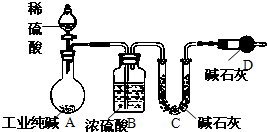 工业纯碱中常常含有NaCl、Na2SO4等杂质.为测定某工业纯碱的纯度,设计了如图实验装置.依据实验设计,请回答:
工业纯碱中常常含有NaCl、Na2SO4等杂质.为测定某工业纯碱的纯度,设计了如图实验装置.依据实验设计,请回答: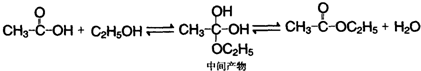
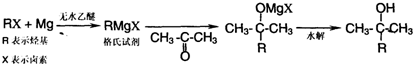
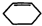 )为原料,通过以下各步转化,最终可制得有机物
)为原料,通过以下各步转化,最终可制得有机物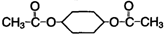 (部分反应过程及反应条件略去)
(部分反应过程及反应条件略去)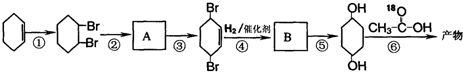
 根据正放在桌面上的如图装置,回答下列问题:
根据正放在桌面上的如图装置,回答下列问题: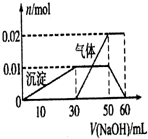 某无色透明溶液只可能含有Ba2+、NH4+、K+、Al3+、Fe 3+、Cl-、SO42-离子中的几种
某无色透明溶液只可能含有Ba2+、NH4+、K+、Al3+、Fe 3+、Cl-、SO42-离子中的几种