题目内容
 (1)汽车内燃机工作时发生反应:N2(g)+O2(g)?2NO(g),是导致汽车尾气中含有NO的原因之一.T℃时,向5L密闭容器中充入6.5molN2和7.5molO2,在5min时反应达到平衡状态,此时容器中NO的物质的量是5mol.
(1)汽车内燃机工作时发生反应:N2(g)+O2(g)?2NO(g),是导致汽车尾气中含有NO的原因之一.T℃时,向5L密闭容器中充入6.5molN2和7.5molO2,在5min时反应达到平衡状态,此时容器中NO的物质的量是5mol.①5min内该反应的平均速率υ(NO)=
②若保持温度不变,平衡后再向容器中同时充入1molN2、1molNO,平衡将
(2)在一定温度下,体积不变的密闭容器中充入一定量的NO和CO,已知:
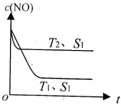
2NO(g)+2CO(g)?2CO2(g)+N2(g)当质量一定时,增大固体催化剂的表面积可提高化学反应速率.其中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线如图:
请回答下列问题:
①该反应的△H
②判断该反应达到平衡的标志是
A.v生成(CO2)=v(CO)
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.NO、N2、O2的浓度均不再变化
③若催化剂的表面积S1>S2,在图中画出c(NO)在T1、S2条件下达到平衡过程中的变化曲线.
考点:化学平衡的计算
专题:
分析:(1)①利用三段法“开始 变化 平衡”列出各组分数据,代入化学反应速率和化学平衡常数表达式计算;
②根据Qc和K的关系来判断反应的方向;
(2)①根据温度对反应平衡移动的影响来回答;
②当达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量不变,可以此判断是否得到平衡状态;
③若催化剂的表面积S1>S2,在T1、S2条件下达到的平衡和T1、S1条件下达到的平衡一样,但是反应速率减慢了,据此回答.
②根据Qc和K的关系来判断反应的方向;
(2)①根据温度对反应平衡移动的影响来回答;
②当达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量不变,可以此判断是否得到平衡状态;
③若催化剂的表面积S1>S2,在T1、S2条件下达到的平衡和T1、S1条件下达到的平衡一样,但是反应速率减慢了,据此回答.
解答:
解:(1)①由题中所给数据可知:
N2(g)+O2(g)?2NO(g)
起始浓度(mol?L-1)1.3 1.5 0
转化浓度(mol?L-1)0.5 0.5 1.0
平衡浓度(mol?L-1)0.8 1.0 1.0
则υ(NO)=
=0.2mol/(L?min),K=
=
=1.25,
故答案为:0.2mol/(L?min);1.25;
②若保持温度不变,平衡后再向容器中同时充入1molN2、1molNO,
N2(g)+O2(g)?2NO(g)
起始浓度(mol?L-1)1.0+0.8 1.2 1.0+1.0
Qc=
≈1.85>1.25,Qc>K,反应逆向移动,故答案为:向左;
(2)①根据图示内容知道,温度大小是T2>T1,升高温度,NO的浓度增大,所以平衡正向移动,所以正反应是吸热反应,即△H>0,故答案为:>;
②A.v生成(CO2)=v(CO)不能说明正逆反应速率相等,故A错误;
B.混合气体的密度=
,m、V都不变,密度始终不变,所以密度不变不一定平衡,故B错误;
C.混合气体的平均相对分子质量M=
,质量不变,n变化,所以当M不变,达到了平衡,故C正确;
D.NO、N2、O2的浓度均不再变化是平衡的特征,故D正确.
故选C、D.
③若催化剂的表面积S1>S2,在T1、S2条件下达到的平衡和T1、S1条件下达到的平衡一样,但是反应速率减慢了,c(NO)在T1、S2条件下达到平衡过程中的变化曲线如右图所示:
故答案为: .
.
N2(g)+O2(g)?2NO(g)
起始浓度(mol?L-1)1.3 1.5 0
转化浓度(mol?L-1)0.5 0.5 1.0
平衡浓度(mol?L-1)0.8 1.0 1.0
则υ(NO)=
| 1.0mol/L |
| 5min |
| c2(NO) |
| c(N2)?c(O2) |
| 1.02 |
| 0.8×1.0 |
故答案为:0.2mol/(L?min);1.25;
②若保持温度不变,平衡后再向容器中同时充入1molN2、1molNO,
N2(g)+O2(g)?2NO(g)
起始浓度(mol?L-1)1.0+0.8 1.2 1.0+1.0
Qc=
| 2.02 |
| 1.8×1.2 |
(2)①根据图示内容知道,温度大小是T2>T1,升高温度,NO的浓度增大,所以平衡正向移动,所以正反应是吸热反应,即△H>0,故答案为:>;
②A.v生成(CO2)=v(CO)不能说明正逆反应速率相等,故A错误;
B.混合气体的密度=
| m |
| V |
C.混合气体的平均相对分子质量M=
| m |
| n |
D.NO、N2、O2的浓度均不再变化是平衡的特征,故D正确.
故选C、D.
③若催化剂的表面积S1>S2,在T1、S2条件下达到的平衡和T1、S1条件下达到的平衡一样,但是反应速率减慢了,c(NO)在T1、S2条件下达到平衡过程中的变化曲线如右图所示:

故答案为:
 .
.
点评:本题涉及反应速率和化学平衡的综合应用,应用盖斯定律求焓变,培养学生的平衡思想,综合性强,难度中等,三段式是解平衡题常用的方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
已知CO(g)、H2(g)和CH3OH(l)的燃烧热(△H)分别为-283.0kJ?mol-1、-285.8kJ?mol-1和-726.5kJ?mol-1,则由CO(g)和H2(g)反应生成1molCH3OH(l)的△H 为( )
| A、-128.1 kJ?mol-1 |
| B、-411.1 kJ?mol-1 |
| C、-157.7 kJ?mol-1 |
| D、+157.7 kJ?mol-1 |
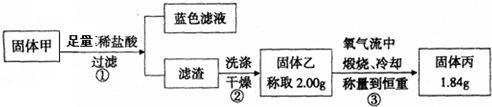
 根据正放在桌面上的如图装置,回答下列问题:
根据正放在桌面上的如图装置,回答下列问题:
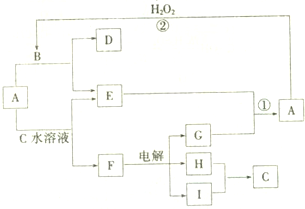 A-I均为中学化学常见的物质,其转化关系如图所示(部分产物已略去).已知:A为酸式盐,且A是焰色反应为紫色(透过蓝色钴玻璃);B与A的组成元素完全相同;C、E、H、I为气体,且H、I为单质.
A-I均为中学化学常见的物质,其转化关系如图所示(部分产物已略去).已知:A为酸式盐,且A是焰色反应为紫色(透过蓝色钴玻璃);B与A的组成元素完全相同;C、E、H、I为气体,且H、I为单质.